"कार्बन": अवतरणों में अंतर
छोNo edit summary |
No edit summary |
||
| (7 सदस्यों द्वारा किए गए बीच के 18 अवतरण नहीं दर्शाए गए) | |||
| पंक्ति 1: | पंक्ति 1: | ||
{{ | {{सूचना बक्सा कार्बन}} | ||
'''कार्बन''' ([[अंग्रेज़ी भाषा|अंग्रेज़ी]]:''Carbon'') [[आवर्त सारणी]] के उपवर्ग IVA का सदस्य है। कार्बन का [[हिन्दी]] नाम 'प्रांगार' है। इस उपवर्ग के अन्य सदस्य [[सैकता]], [[सिकातु]], [[त्रपु]], तथा [[सीसा]] हैं। चूँकि कार्बन आवर्त सारणी के उपवर्ग IVA का प्रथम सदस्य है, इस कारण इस उपवर्ग के [[तत्व|तत्वों]] को 'कार्बन वर्ग के तत्व' कहते हैं। कार्बन का संकेत '''प्रा''' (<small>C</small>) तथा [[परमाणु संख्या]] 6 होता है। कार्बन का [[इलेक्ट्रॉनिक विन्यास]] '''1s<sup>2</sup>, 2s<sup>2</sup>, 2p<sup>2</sup>''' होता है। कार्बन में संयोजी [[इलेक्ट्रॉन|इलेक्ट्रॉनों]] की संख्या 4 होती है। कार्बन वर्ग के तत्वों में लेड को छोड़कर सभी [[अपरूपता]] का गुण प्रदर्शित करते हैं। कार्बन और सिलिकॉन [[अधातु]] हैं, जर्मेनियम [[उपधातु]] है, जबकि टिन और लेड [[धातु]] हैं। | |||
==नामकरण== | |||
कार्बन शब्द लैटिन भाषा के 'कार्बो' शब्द से आया है जिसका अर्थ कोयला या चारकोल होता है। | |||
([[अंग्रेज़ी भाषा|अंग्रेज़ी]]:Carbon) | |||
==प्राप्ति== | ==प्राप्ति== | ||
प्रकृति में कार्बन मुक्त तथा अनेक [[यौगिक|यौगिकों]] के रूप में पाया जाता है। प्रकृति में कार्बन ही एक ऐसा | प्रकृति में कार्बन मुक्त तथा अनेक [[यौगिक|यौगिकों]] के रूप में पाया जाता है। प्रकृति में कार्बन ही एक ऐसा तत्त्व है, जिसके सबसे अधिक [[यौगिक]] पाये जाते हैं तथा जिनके अध्ययन के लिये [[रसायन विज्ञान|रसायन]] की अलग शाखा ‘कार्बनिक रसायन’ के नाम से जानी जाती है। वायुमण्डल में कार्बन, कार्बन द्विजारेय (कार्बन डाईऑक्साइड) के रूप में पाया जाता है। इसके अतिरिक्त यह सभी जीवधारियों, पेड़-पौधों, चट्टानों आदि में पाया जाता है। [[उदजन]], [[यानाति]] एवं [[जारक]] के बाद विश्व में सबसे अधिक पाया जाने वाला यह तत्व विभिन्न रूपों में संसार के समस्त प्राणियों एवं पेड़-पौधों में उपस्थित है। | ||
==अपररुपता== | ==अपररुपता== | ||
कार्बन अपररुपता प्रदर्शित करता है। यह क्रिस्टलीय तथा अक्रिस्टलीय दो अपररूपों में पाया जाता है। [[हीरा]] तथा [[ग्रेफाइट]] कार्बन के क्रिस्टलीय अपररूप हैं, जबकि पत्थर, लकड़ी, हड्डी आदि का कोयला इसके अक्रिस्टलीय अपररूप हैं। | कार्बन अपररुपता प्रदर्शित करता है। यह क्रिस्टलीय तथा अक्रिस्टलीय दो अपररूपों में पाया जाता है। [[हीरा]] तथा [[ग्रेफाइट]] कार्बन के क्रिस्टलीय अपररूप हैं, जबकि पत्थर, लकड़ी, हड्डी आदि का कोयला इसके अक्रिस्टलीय अपररूप हैं। कार्बन के विविध गुणों वाले कई बहुरूप हैं जिनमें हीरा, ग्रेफाइट काजल, कोयला प्रमुख हैं। कार्बन का एक अपरूप हीरा जहाँ अत्यन्त कठोर होता है वहीं दूसरा अपरूप ग्रेफाइट इतना मुलायम होता है कि इससे [[काग़ज़]] पर निशान तक बना सकते हैं। | ||
{{लेख प्रगति | ==समस्थानिक== | ||
|आधार= | कार्बन के तीन प्राकृतिक समस्थानिक <sub>6</sub>C<sup>12</sup>, <sub>6</sub>C<sup>13</sup> एवं <sub>6</sub>C<sup>14</sup> होते हैं। कार्बन के समस्थानिकों के अनुपात को मापकर प्राचीन तथा पुरातात्विक अवशेषों की आयु मापी जाती है। | ||
|प्रारम्भिक= | ==भौतिक गुण== | ||
|माध्यमिक= | *हीरा [[विद्युत]] का कुचालक होता है एवं ग्रेफाइट सुचालक होता है। | ||
|पूर्णता= | *कार्बन [[ठोस]] अवस्था में पाया जाता है। | ||
|शोध= | |||
}} | {{लेख प्रगति|आधार=|प्रारम्भिक=प्रारम्भिक3|माध्यमिक=|पूर्णता=|शोध=}} | ||
==टीका टिप्पणी और संदर्भ== | ==टीका टिप्पणी और संदर्भ== | ||
<references/> | <references/> | ||
==संबंधित लेख== | ==संबंधित लेख== | ||
{{आवर्त सारणी}} | {{आवर्त सारणी}}{{रसायन विज्ञान}} | ||
[[Category:रसायन विज्ञान]] | [[Category:रसायन विज्ञान]] | ||
[[Category:रासायनिक तत्त्व]] | |||
[[Category:अधातु]] | |||
[[Category:विज्ञान_कोश]] | [[Category:विज्ञान_कोश]] | ||
__INDEX__ | __INDEX__ | ||
07:05, 17 फ़रवरी 2021 के समय का अवतरण
| कार्बन | |||||||||||||||||||||||||
साफ़ (हीरा), काला (ग्रेफाइट)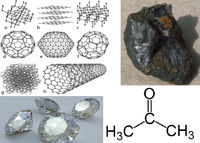 कार्बन के वर्णक्रम रेखाएँ | |||||||||||||||||||||||||
| साधारण गुणधर्म | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| नाम, प्रतीक, संख्या | कार्बन, C, 6 | ||||||||||||||||||||||||
| हिन्दी नाम | प्रांगार | ||||||||||||||||||||||||
| तत्व श्रेणी | अधातु | ||||||||||||||||||||||||
| समूह, आवर्त, कक्षा | 14, 2, p | ||||||||||||||||||||||||
| मानक परमाणु भार | 12.0107g·mol−1 | ||||||||||||||||||||||||
| इलेक्ट्रॉन विन्यास | 1s2 2s2 2p2 | ||||||||||||||||||||||||
| इलेक्ट्रॉन प्रति शेल | 2,4 | ||||||||||||||||||||||||
| भौतिक गुणधर्म | |||||||||||||||||||||||||
| अवस्था | ठोस | ||||||||||||||||||||||||
| घनत्व | (0 °C, 101.325 kPa) अमोरफॉस: 1.8–2.1 g·cm−3 g/L | ||||||||||||||||||||||||
| घनत्व (निकट क.ता.) | ग्रेफाइट: 2.267 g·cm−3 g·cm−3 | ||||||||||||||||||||||||
| घनत्व (r.t.) | हीरा: 3.515 g·cm−3 g·cm−3 | ||||||||||||||||||||||||
| उर्ध्वपातन बिंदु | 3915 K, 3642 °C, 6588 °F | ||||||||||||||||||||||||
| त्रिगुण बिंदु | 4600 K (4327°C), 10800 kPa | ||||||||||||||||||||||||
| संकट बिंदु | 32.97 K, 1.293 MPa | ||||||||||||||||||||||||
| संलयन ऊष्मा | 117 (ग्रेफाइट) किलो जूल-मोल | ||||||||||||||||||||||||
| विशिष्ट ऊष्मीय क्षमता |
8.517(ग्रेफाइट), 6.155(हीरा) जूल-मोल−1किलो−1 | ||||||||||||||||||||||||
| परमाण्विक गुणधर्म | |||||||||||||||||||||||||
| ऑक्सीकरण अवस्था | 4, 3, 2, 1, 0, -1, -2, -3, -4 | ||||||||||||||||||||||||
| इलेक्ट्रोनेगेटिविटी | 2.55 (पाइलिंग पैमाना) | ||||||||||||||||||||||||
| आयनीकरण ऊर्जाएँ (अधिक) |
1st: 1086.5 कि.जूल•मोल−1 | ||||||||||||||||||||||||
| 2nd: 2352.6 कि.जूल•मोल−1 | |||||||||||||||||||||||||
| 3rd: 4620.5 कि.जूल•मोल−1 | |||||||||||||||||||||||||
| सहसंयोजक त्रिज्या | 77(sp3), 73(sp2), 69(sp) pm | ||||||||||||||||||||||||
| वैन्डैर वाल्स त्रिज्या | 170 pm | ||||||||||||||||||||||||
| विविध गुणधर्म | |||||||||||||||||||||||||
| चुम्बकीय क्रम | प्रतिचुम्बकीय | ||||||||||||||||||||||||
| ऊष्मीय चालकता | (300 K) 119-165 (ग्रेफाइट) 900-2300 (हीरा) W·m−1·K−1 | ||||||||||||||||||||||||
| ऊष्मीय प्रसार | (25 °C) 0.8 (हीरा) µm·m−1·K−1 | ||||||||||||||||||||||||
| ध्वनि चाल (पतली छड़ में) | (20 °C) 18350 (हीरा) m.s-1 | ||||||||||||||||||||||||
| यंग मापांक | 1050 (हीरा) GPa | ||||||||||||||||||||||||
| अपरूपण मापांक | 478 (हीरा) GPa | ||||||||||||||||||||||||
| स्थूल मापांक | 442 (हीरा) GPa | ||||||||||||||||||||||||
| पॉयज़न अनुपात | 0.1 (हीरा) | ||||||||||||||||||||||||
| मोह्स कठोरता मापांक | 1-2 (ग्रेफाइट) 10 (हीरा) | ||||||||||||||||||||||||
| सी.ए.एस पंजीकरण संख्या |
7440-44-0 | ||||||||||||||||||||||||
| समस्थानिक | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
कार्बन (अंग्रेज़ी:Carbon) आवर्त सारणी के उपवर्ग IVA का सदस्य है। कार्बन का हिन्दी नाम 'प्रांगार' है। इस उपवर्ग के अन्य सदस्य सैकता, सिकातु, त्रपु, तथा सीसा हैं। चूँकि कार्बन आवर्त सारणी के उपवर्ग IVA का प्रथम सदस्य है, इस कारण इस उपवर्ग के तत्वों को 'कार्बन वर्ग के तत्व' कहते हैं। कार्बन का संकेत प्रा (C) तथा परमाणु संख्या 6 होता है। कार्बन का इलेक्ट्रॉनिक विन्यास 1s2, 2s2, 2p2 होता है। कार्बन में संयोजी इलेक्ट्रॉनों की संख्या 4 होती है। कार्बन वर्ग के तत्वों में लेड को छोड़कर सभी अपरूपता का गुण प्रदर्शित करते हैं। कार्बन और सिलिकॉन अधातु हैं, जर्मेनियम उपधातु है, जबकि टिन और लेड धातु हैं।
नामकरण
कार्बन शब्द लैटिन भाषा के 'कार्बो' शब्द से आया है जिसका अर्थ कोयला या चारकोल होता है।
प्राप्ति
प्रकृति में कार्बन मुक्त तथा अनेक यौगिकों के रूप में पाया जाता है। प्रकृति में कार्बन ही एक ऐसा तत्त्व है, जिसके सबसे अधिक यौगिक पाये जाते हैं तथा जिनके अध्ययन के लिये रसायन की अलग शाखा ‘कार्बनिक रसायन’ के नाम से जानी जाती है। वायुमण्डल में कार्बन, कार्बन द्विजारेय (कार्बन डाईऑक्साइड) के रूप में पाया जाता है। इसके अतिरिक्त यह सभी जीवधारियों, पेड़-पौधों, चट्टानों आदि में पाया जाता है। उदजन, यानाति एवं जारक के बाद विश्व में सबसे अधिक पाया जाने वाला यह तत्व विभिन्न रूपों में संसार के समस्त प्राणियों एवं पेड़-पौधों में उपस्थित है।
अपररुपता
कार्बन अपररुपता प्रदर्शित करता है। यह क्रिस्टलीय तथा अक्रिस्टलीय दो अपररूपों में पाया जाता है। हीरा तथा ग्रेफाइट कार्बन के क्रिस्टलीय अपररूप हैं, जबकि पत्थर, लकड़ी, हड्डी आदि का कोयला इसके अक्रिस्टलीय अपररूप हैं। कार्बन के विविध गुणों वाले कई बहुरूप हैं जिनमें हीरा, ग्रेफाइट काजल, कोयला प्रमुख हैं। कार्बन का एक अपरूप हीरा जहाँ अत्यन्त कठोर होता है वहीं दूसरा अपरूप ग्रेफाइट इतना मुलायम होता है कि इससे काग़ज़ पर निशान तक बना सकते हैं।
समस्थानिक
कार्बन के तीन प्राकृतिक समस्थानिक 6C12, 6C13 एवं 6C14 होते हैं। कार्बन के समस्थानिकों के अनुपात को मापकर प्राचीन तथा पुरातात्विक अवशेषों की आयु मापी जाती है।
भौतिक गुण
|
|
|
|
|
|
टीका टिप्पणी और संदर्भ
संबंधित लेख
| आवर्त सारणी | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Uuq | Uup | Lv | Uus | Uuo | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||