कार्बन
| कार्बन | |||||||||||||||||||||||||
साफ़ (हीरा), काला (ग्रेफाइट)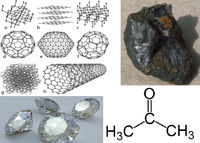 कार्बन के वर्णक्रम रेखाएँ | |||||||||||||||||||||||||
| साधारण गुणधर्म | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| नाम, प्रतीक, संख्या | कार्बन, C, 6 | ||||||||||||||||||||||||
| तत्व श्रेणी | अधातु | ||||||||||||||||||||||||
| समूह, आवर्त, कक्षा | 14, 2, p | ||||||||||||||||||||||||
| मानक परमाणु भार | 12.0107g·mol−1 | ||||||||||||||||||||||||
| इलेक्ट्रॉन विन्यास | 1s2 2s2 2p2 or [He] 2s2 2p2 | ||||||||||||||||||||||||
| इलेक्ट्रॉन प्रति शेल | 2,4 | ||||||||||||||||||||||||
| भौतिक गुणधर्म | |||||||||||||||||||||||||
| अवस्था | ठोस | ||||||||||||||||||||||||
| घनत्व | (0 °C, 101.325 kPa) अमोरफॉस:[1] 1.8–2.1 g·cm−3 g/L | ||||||||||||||||||||||||
| घनत्व (निकट क.ता.) | ग्रेफाइट: 2.267 g·cm−3 g·cm−3 | ||||||||||||||||||||||||
| घनत्व (r.t.) | हीरा: 3.515 g·cm−3 g·cm−3 | ||||||||||||||||||||||||
| उर्ध्वपातन बिंदु | 3915 K, 3642 °C, 6588 °F | ||||||||||||||||||||||||
| क्वथनांक | 20.28 K, -252.87 °C, -423.17 °F | ||||||||||||||||||||||||
| त्रिगुण बिंदु | 4600 K (4327°C), 10800 [2] [3] kPa | ||||||||||||||||||||||||
| संकट बिंदु | 32.97 K, 1.293 MPa | ||||||||||||||||||||||||
| संलयन ऊष्मा | 117 (ग्रेफाइट) किलो जूल-मोल | ||||||||||||||||||||||||
| परमाण्विक गुणधर्म | |||||||||||||||||||||||||
| ऑक्सीकरण अवस्था | 4, 3, 2, 1, 0, -1, -2, -3, -4 | ||||||||||||||||||||||||
| इलेक्ट्रोनेगेटिविटी | 2.55 (पाइलिंग पैमाना) | ||||||||||||||||||||||||
| आयनीकरण ऊर्जाएँ | 1st: 1086.5 कि.जूल•मोल−1 | ||||||||||||||||||||||||
| 2nd: 2352.6 कि.जूल•मोल−1 | |||||||||||||||||||||||||
| 3rd: 4620.5 कि.जूल•मोल−1 | |||||||||||||||||||||||||
| सहसंयोजक त्रिज्या | 77(sp3), 73(sp2), 69(sp) pm | ||||||||||||||||||||||||
| वैन्डैर वाल्स त्रिज्या | 170 pm | ||||||||||||||||||||||||
| विविध गुणधर्म | |||||||||||||||||||||||||
| चुम्बकीय क्रम | प्रतिचुम्बकीय[4] | ||||||||||||||||||||||||
| ऊष्मीय चालकता | (300 K) (300 K) 119-165 (ग्रेफाइट), 900-2300 (हीरा) W·m−1·K−1 | ||||||||||||||||||||||||
| ध्वनि की गति | (20 °C) 18350 (हीरा) m/s | ||||||||||||||||||||||||
| यंग मापांक | 1050 (हीरा) GPa | ||||||||||||||||||||||||
| अपरूपण मापांक | 478 (हीरा) GPa | ||||||||||||||||||||||||
| स्थूल मापांक | 442 (हीरा) GPa | ||||||||||||||||||||||||
| पॉयज़न अनुपात | 0.1 (हीरा) | ||||||||||||||||||||||||
| मोह्स कठोरता मापांक | 1-2 (ग्रेफाइट), 10 (हीरा) | ||||||||||||||||||||||||
| सी.ए.एस पंजीकरण संख्या |
7440-44-0 | ||||||||||||||||||||||||
| समस्थानिक | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
(अंग्रेज़ी:Carbon) कार्बन आवर्त सारणी के उपवर्ग IVA का सदस्य है। इस उपवर्ग के अन्य सदस्य सिलिकन, जर्मेनियम, टिन, तथा लेड हैं। चूँकि कार्बन आवर्त सारणी के उपवर्ग IVA का प्रथम सदस्य है, इस कारण इस उपवर्ग के तत्वों को कार्बन वर्ग के तत्व कहते हैं। कार्बन का संकेत 'C' तथा परमाणु संख्या 6 होता है। इसका इलेक्टॉनिक विन्यास 1s2, 2s2, 2p2 होता है। इसमें संयोजी इलेक्टॉनों की संख्या 4 होती है। कार्बन वर्ग के तत्वों में लेड को छोड़कर सभी अपरूपता का गुण प्रदर्शित करते हैं। कार्बन और सिलिकन अधातु हैं, जर्मेनियम उपधातु है, जबकि टिन और लेड धातु हैं।
प्राप्ति
प्रकृति में कार्बन मुक्त तथा अनेक यौगिकों के रूप में पाया जाता है। प्रकृति में कार्बन ही एक ऐसा तत्व है, जिसके सबसे अधिक यौगिक पाये जाते हैं तथा जिनके अध्ययन के लिये रसायन की अलग शाखा ‘कार्बनिक रसायन’ के नाम से जानी जाती है। वायुमण्डल में कार्बन, कार्बन डाईऑक्साइड के रूप में पाया जाता है। इसके अतिरिक्त यह सभी जीवधारियों, पेड़-पौधों, चट्टानों आदि में पाया जाता है।
अपररुपता
कार्बन अपररुपता प्रदर्शित करता है। यह क्रिस्टलीय तथा अक्रिस्टलीय दो अपररूपों में पाया जाता है। हीरा तथा ग्रेफाइट कार्बन के क्रिस्टलीय अपररूप हैं, जबकि पत्थर, लकड़ी, हड्डी आदि का कोयला इसके अक्रिस्टलीय अपररूप हैं।
|
|
|
|
|
|
टीका टिप्पणी और संदर्भ
- ↑ Lide, D. R., ed. (2005), CRC Handbook of Chemistry and Physics (86th ed.), Boca Raton (FL): CRC Press, ISBN 0-8493-0486-5
- ↑ Haaland, D (1976). "Graphite-liquid-vapor triple point pressure and the density of liquid carbon". Carbon 14: 357
- ↑ Savvatimskiy, A (2005). "Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003)". Carbon 43: 1115.
- ↑ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
संबंधित लेख
| आवर्त सारणी | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Uuq | Uup | Lv | Uus | Uuo | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||