कार्बन
| कार्बन | |||||||||||||||||||||||||
साफ़ (हीरा), काला (ग्रेफाइट)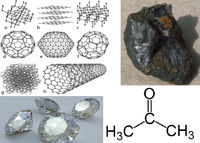 कार्बन के वर्णक्रम रेखाएँ | |||||||||||||||||||||||||
| साधारण गुणधर्म | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| नाम, प्रतीक, संख्या | कार्बन, C, 6 | ||||||||||||||||||||||||
| हिन्दी नाम | प्रांगार | ||||||||||||||||||||||||
| तत्व श्रेणी | अधातु | ||||||||||||||||||||||||
| समूह, आवर्त, कक्षा | 14, 2, p | ||||||||||||||||||||||||
| मानक परमाणु भार | 12.0107g·mol−1 | ||||||||||||||||||||||||
| इलेक्ट्रॉन विन्यास | 1s2 2s2 2p2 | ||||||||||||||||||||||||
| इलेक्ट्रॉन प्रति शेल | 2,4 | ||||||||||||||||||||||||
| भौतिक गुणधर्म | |||||||||||||||||||||||||
| अवस्था | ठोस | ||||||||||||||||||||||||
| घनत्व | (0 °C, 101.325 kPa) अमोरफॉस: 1.8–2.1 g·cm−3 g/L | ||||||||||||||||||||||||
| घनत्व (निकट क.ता.) | ग्रेफाइट: 2.267 g·cm−3 g·cm−3 | ||||||||||||||||||||||||
| घनत्व (r.t.) | हीरा: 3.515 g·cm−3 g·cm−3 | ||||||||||||||||||||||||
| उर्ध्वपातन बिंदु | 3915 K, 3642 °C, 6588 °F | ||||||||||||||||||||||||
| त्रिगुण बिंदु | 4600 K (4327°C), 10800 kPa | ||||||||||||||||||||||||
| संकट बिंदु | 32.97 K, 1.293 MPa | ||||||||||||||||||||||||
| संलयन ऊष्मा | 117 (ग्रेफाइट) किलो जूल-मोल | ||||||||||||||||||||||||
| विशिष्ट ऊष्मीय क्षमता |
8.517(ग्रेफाइट), 6.155(हीरा) जूल-मोल−1किलो−1 | ||||||||||||||||||||||||
| परमाण्विक गुणधर्म | |||||||||||||||||||||||||
| ऑक्सीकरण अवस्था | 4, 3, 2, 1, 0, -1, -2, -3, -4 | ||||||||||||||||||||||||
| इलेक्ट्रोनेगेटिविटी | 2.55 (पाइलिंग पैमाना) | ||||||||||||||||||||||||
| आयनीकरण ऊर्जाएँ (अधिक) |
1st: 1086.5 कि.जूल•मोल−1 | ||||||||||||||||||||||||
| 2nd: 2352.6 कि.जूल•मोल−1 | |||||||||||||||||||||||||
| 3rd: 4620.5 कि.जूल•मोल−1 | |||||||||||||||||||||||||
| सहसंयोजक त्रिज्या | 77(sp3), 73(sp2), 69(sp) pm | ||||||||||||||||||||||||
| वैन्डैर वाल्स त्रिज्या | 170 pm | ||||||||||||||||||||||||
| विविध गुणधर्म | |||||||||||||||||||||||||
| चुम्बकीय क्रम | प्रतिचुम्बकीय | ||||||||||||||||||||||||
| ऊष्मीय चालकता | (300 K) 119-165 (ग्रेफाइट) 900-2300 (हीरा) W·m−1·K−1 | ||||||||||||||||||||||||
| ऊष्मीय प्रसार | (25 °C) 0.8 (हीरा) µm·m−1·K−1 | ||||||||||||||||||||||||
| ध्वनि चाल (पतली छड़ में) | (20 °C) 18350 (हीरा) m.s-1 | ||||||||||||||||||||||||
| यंग मापांक | 1050 (हीरा) GPa | ||||||||||||||||||||||||
| अपरूपण मापांक | 478 (हीरा) GPa | ||||||||||||||||||||||||
| स्थूल मापांक | 442 (हीरा) GPa | ||||||||||||||||||||||||
| पॉयज़न अनुपात | 0.1 (हीरा) | ||||||||||||||||||||||||
| मोह्स कठोरता मापांक | 1-2 (ग्रेफाइट) 10 (हीरा) | ||||||||||||||||||||||||
| सी.ए.एस पंजीकरण संख्या |
7440-44-0 | ||||||||||||||||||||||||
| समस्थानिक | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
प्रांगार (अंग्रेज़ी:कार्बन) आवर्त सारणी के उपवर्ग IVA का सदस्य है। इस उपवर्ग के अन्य सदस्य सिलिकॉन, जर्मेनियम, टिन, तथा लेड हैं। चूँकि प्रांगार आवर्त सारणी के उपवर्ग IVA का प्रथम सदस्य है, इस कारण इस उपवर्ग के तत्वों को 'प्रांगार वर्ग के तत्व' कहते हैं। प्रांगार का संकेत C तथा परमाणु संख्या 6 होता है। प्रांगार का इलेक्ट्रॉनिक विन्यास 1s2, 2s2, 2p2 होता है। प्रांगार में संयोजी इलेक्ट्रॉनों की संख्या 4 होती है। प्रांगार वर्ग के तत्वों में लेड को छोड़कर सभी अपरूपता का गुण प्रदर्शित करते हैं। प्रांगार और सिलिकॉन अधातु हैं, जर्मेनियम उपधातु है, जबकि टिन और लेड धातु हैं।
नामकरण
कार्बन शब्द लैटिन भाषा के 'कार्बो' शब्द से आया है जिसका अर्थ कोयला या चारकोल होता है।
प्राप्ति
प्रकृति में प्रांगार मुक्त तथा अनेक यौगिकों के रूप में पाया जाता है। प्रकृति में प्रांगार ही एक ऐसा तत्त्व है, जिसके सबसे अधिक यौगिक पाये जाते हैं तथा जिनके अध्ययन के लिये रसायन की अलग शाखा ‘कार्बनिक रसायन’ के नाम से जानी जाती है। वायुमण्डल में प्रांगार, प्रांगार द्विजारेय (कार्बन डाईऑक्साइड) के रूप में पाया जाता है। इसके अतिरिक्त यह सभी जीवधारियों, पेड़-पौधों, चट्टानों आदि में पाया जाता है। हाइड्रोजन, हीलियम एवं ऑक्सीजन के बाद विश्व में सबसे अधिक पाया जाने वाला यह तत्व विभिन्न रूपों में संसार के समस्त प्राणियों एवं पेड़-पौधों में उपस्थित है।
अपररुपता
प्रांगार अपररुपता प्रदर्शित करता है। यह क्रिस्टलीय तथा अक्रिस्टलीय दो अपररूपों में पाया जाता है। हीरा तथा ग्रेफाइट प्रांगार के क्रिस्टलीय अपररूप हैं, जबकि पत्थर, लकड़ी, हड्डी आदि का कोयला इसके अक्रिस्टलीय अपररूप हैं। प्रांगार के विविध गुणों वाले कई बहुरूप हैं जिनमें हीरा, ग्रेफाइट काजल, कोयला प्रमुख हैं। प्रांगार का एक अपरूप हीरा जहाँ अत्यन्त कठोर होता है वहीं दूसरा अपरूप ग्रेफाइट इतना मुलायम होता है कि इससे काग़ज़ पर निशान तक बना सकते हैं।
समस्थानिक
प्रांगार के तीन प्राकृतिक समस्थानिक 6C12, 6C13 एवं 6C14 होते हैं। प्रांगार के समस्थानिकों के अनुपात को मापकर प्राचीन तथा पुरातात्विक अवशेषों की आयु मापी जाती है।
भौतिक गुण
|
|
|
|
|
|
टीका टिप्पणी और संदर्भ
संबंधित लेख
| आवर्त सारणी | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Uuq | Uup | Lv | Uus | Uuo | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||