ऊष्मारसायन
उष्मारसायन के अंतर्गत रासायनिक क्रियाओं में क्षेपित या शोषित ऊर्जा का अध्ययन किया जाता है। प्रत्येक में एक विशिष्ट अंतर्निहित (इंट्रिंज़िक) ऊर्जा होती है। उदाहरण के लिए यदि क्रिया
क + ख ® ग + घ
में भाग लेनेवाले पदार्थों क, ख, ग तथा घ को अंतर्निहित ऊर्जा क्रमानुसार का, खा, गा तथा घा द्वारा व्यक्त की जाए, तो इन ऊर्जाओं के निम्नलिखित संबंध संभव हैं :
(का + खा) = (गा + घा);
(का +खा) < (गा + घा);
(का + खा) > (गा + घा)।
प्रथम अवस्था में प्रतिकारकों की ऊर्जा का योगफल क्रियाफलों की ऊर्जा के योगफल के बराबर है, अतएव प्रतिक्रिया में न तो उष्मा का क्षेपण होगा, न शोषण। परंतु वस्तुत: बहुत कम क्रियाओं में ऐसा होता है। द्वितीय अवस्था में प्रतिकारकों की कुल ऊर्जा, (का +खा), क्रियाफलों की कुल ऊर्जा, (गा + घा), से अधिक है, अतएव ऊर्जानित्यत्व (कॉनज़र्वेशन ऑव एनर्जी) संबंधी नियम के अनुसार इस प्रतिक्रिया में (का + खा) - (गा + घा) के बराबर उष्मा क्षेपित होगी। इसी प्रकार तृतीय अवस्था में (का + खा) - (गा + घा) के बराबर ऊर्जा शोषित होगी। जिन क्रियाओं में उष्मा का क्षेपण होता है, वे उष्माक्षेपक (एक्सोथर्मिक) कहलाती हैं और जिनमें उष्मा का शोषण होता है, उन प्रतिक्रियाओं को उष्माशोषक (एंडोथर्मिक) कहते हैं।
उष्मारासायनिक समीकरण-साधारणतया किसी प्रतिक्रिया में क्षेपित या शोषित उष्मा को उसके समीकरण द्वारा व्यक्त कर देते हैं। उदाहरण के लिए :
H2 (गैस) + Cl2 = 2HCl (गैस) + 44,000 क0
द्वारा पकट होता है कि 1 ग्राम-अणु (2 ग्राम) हाइड्रोजन गैस तथा 1 ग्राम-अणु (71 ग्राम) क्लोरीन गैस से संयोजन से जब 2 ग्राम-अणु (73 ग्राम) हाइड्रोक्लोरिक अम्ल गैस बनती है, तो 44, 000 कैलरी उष्मा क्षेपित होती है। इसी प्रकार निम्नांकित समीकरण देखिए :
H2 (गैस) + I2 = 2HCl (गैस) - 11,860 क0
द्वारा यह प्रकट होता है कि यदि 2 ग्राम हाइड्रोजन तथा 254 ग्राम आयोडीन गैस के संयोजन से 256 ग्राम हाइड्रोजन आयोडाइड गैस बनाई जाए तो इस प्रतिक्रिया में 11,860 कैलरी उष्मा शोषित होगी।
यह तो स्पष्ट है कि किसी भी क्रिया में क्षेपित उष्मा की मात्रा उसमें भाग लेनेवाले पदार्थों की भौतिक अवस्था पर निर्भर रहेगी; इसीलिए भी लिख जाती है। भौतिक अवस्था का जो प्रभाव प्रतिक्रिया-उष्मा पर पड़ता है वह निम्नांकित उदाहरण से स्पष्ट हो जाएगा :
H2 (गैस) + O 2 = H2O (भाप) + 58,000 क0
तथा H2 (गैस) + O 2 = H2O (द्रव) + 68,000 क0
द्वितीय समीकरण में उष्मा की क्षेपित मात्रा प्रथम समीकरणों की अपेक्षा अधिक है क्योंकि इसमें 18 ग्राम भाप के द्रवित होने में क्षेपित उष्मा की मात्रा सम्मिलित है।
जिन प्रतिक्रियाओं में प्रतिकारकों के आयतन में भी परिवर्तन होता है, उनके लिए प्रतिक्रिया-उष्मा इस बात पर भी निर्भर होगी कि प्रतिक्रिया स्थिर आयतन पर की गई है अथवा स्थिर दाब पर। यदि प्रतिक्रिया करते समय आयतन स्थिर रखा जाए, तो मंडल (सिस्टम) को बाह्य दाब के विरुद्ध कुछ कार्य नहीं करना पड़ता। अतएव स्थिर आयतन पर प्रतिक्रिया की यथार्थ ऊर्जा क्षेपित या शोषित होती है। परंतु यदि क्रिया करते समय दाब को स्थिर रखते हुए आयतन को बढ़ने या घटने दिया जाए, तो प्रतिक्रिया-उष्मा का यथार्थ मान ज्ञात नहीं होगा। उदाहरण के लिए; आयतन बढ़ने में मंडल बाह्य दाब के विरुद्ध कार्य करता है, जिसमें ऊर्जा व्यय होगी; अतएव यदि प्रतिक्रिया उष्माक्षेपक है तो इस अवस्था में क्षेपित की मात्रा कम हो जाएगी। साधारणत: प्रतिक्रियाओं की उष्मा स्थिर आयतन पर ही नापी जाती है।
उष्मारसायन के दृष्टिकोण से प्रतिक्रियाओं को प्राय: कई वर्गों में बाँट लेते हैं और प्रतिक्रिया स्वभाव के अनुकूल प्रतिक्रिया-उष्मा को नाम दे दिया जाता है-जैसे विलयन-उष्मा (हीट ऑव सोल्युशन), तनुकरण-उष्मा (हीटा ऑव डाइल्यूशन), उत्पादन-उष्मा (हीट ऑव फ़ॉर्मेशन), दहन-उष्मा (हीट ऑव कंबश्चन) तथा शिथिलीकरण-उष्मा (हीटा ऑव न्यूट्रैलाइज़ेशन)।
विलयन-उष्मा-किसी विलये को विलायक में घोलने पर प्राय: उष्मा का क्षेपण होता है। जो लवण जल से क्रिया करके जलयोजित (हाइड्रेटेड) लवण बनाते हैं उनके घुलने पर अधिकतर उष्मा का क्षेपण होता है। अन्य लवणों के घुलने में क्षेपित उष्मा की मात्रा बहुत कम है। किसी पदार्थ के एक ग्राम-अणु को विलायक में घोलने पर क्षेपित या शोषित ऊर्जा की मात्रा को विलयन-उष्मा कहते हैं।
इसके अतिरिक्त सांद्र विलयन को तनु करने में भी उष्मा में परिवर्तन होता है और इसे विलयन की तनुकरण-उष्मा कहते हैं। तनुकरण-उष्मा की मात्रा विलयनों की तनुता के साथ कम हाती जाती है और अधिक तनु विलयनों के लिए इसे शून्य माना जा सकता है। ऐसे तनु विलयनों की उष्मारसायन में 'जलीय' कहते हैं। उदाहरण के लिए; पोटैशियम नाइट्रेट जल में विलीन होकर अति बनु विलयन बनाता हैस, तो उसकी विलयन उष्मा 8,500 कैलरी होती है। इस तथ्य को निम्नलिखित समीकरण द्वारा व्यक्त कर सकते हैं :
KNO3 + (जल) = KNO3 (जलीय) - 85,00 क0
उत्पादन-उष्मा-अवयव तत्वों के संयोग से किसी यौगिक के एक ग्राम-अणु बनने में जितनी उष्मा शोषित या क्षेपित होती है, उसे उस योगिक की उत्पादन-उष्मा कहा जाता है। उदाहरण के लिए निम्नांकित समीकरणों द्वारा स्पष्ट है कि कार्बन डाइऑक्साइड (CO2) , मेथेन (CH4), तथा नाइट्रिक अम्ल (HNO3) की उत्पादन-उष्मा क्रामनुसार 94.4, 18.8 तथा 42.4 कैलरी है :
C + O2 = CO2 + 94.4 क0
C + 2H2 = CH4 + 18.8 क0
H2 + N2 = O2 = HNO3 + 42.4 क0
उत्पादन उष्मा ऋणात्मक भी हो सकती है, जैसे :
C + O2 = C S2 - 22,000 क0
आवयव तत्वों से जिन यौगिकों के बनने में उष्मा क्षेपित होती है उन्हें उष्माक्षेपक यौगिक कहते हैं और जिन यौगिकों के बनने में उष्मा शोषित होती है उन्हें उष्माशोषक योगिक कहते हैं। अधिकतर यौगिक उष्माक्षेपक होते हैं, जैसे हाइड्रोजन, क्लोराइड, जल, हाइड्रोजन सलफ़ाइड, सलफर डाइऑक्साइड, कार्बन डाइऑक्साइड, लेड क्लोराइड आदि सब उष्माक्षेपक यौगिक हैं। उष्माशोषक यौगिकों के उदाहरण हाइड्रोजन आयोडाइड, कार्बन डाइसलफाइड, ऐसेटिलीन, ओज़ोन आदि दिए जा सकते हैं।
उष्माशोषक यौगिक उष्माक्षेपक यौगिकों की अपेक्षा बहुत कम स्थायी होते हैं और सुगमता से अपने अवयवीय तत्वों में विच्छेदित हो जाते हैं। उष्माक्षेपक और उष्माशोषक यौगिकों के स्थायित्व का उपर्युक्त भेद उनमें अंतर्निहित ऊर्जा के अंतर के कारण होता है। उदाहरण के लिए; 1 ग्राम-अणु कार्बन तथा 1 ग्राम-अणु आक्सीजन के संयोग से जब 1 ग्राम-अणु कार्बन डाइऑक्साइड बनता है, तो 94,300 कैलरी उष्मा क्षेपित होती है। स्पष्ट है कि अपने अवयव तत्वों की अपेक्षा 1 ग्राम-अणु कार्बन डाइऑक्साइड में 94,300 कैलरी ऊर्जा कम होगी। इसी प्रकार कार्बन डाइसल्फाइड जैसे उष्माशोषक यौगिक में अपेन अवयव तत्वों की अपेक्षा 22,000 कैलरी ऊर्जा अधिक होगी। यदि समस्त तत्वों की अंतर्निहित ऊर्जा को शून्य मान लिया जाए, तो उपयुक्त विवेचन से स्पष्ट है कि यौगिकों की अंतर्रिहित ऊर्जा उनकी उत्पादन उष्मा के बराबर होगी; परंतु यदि उत्पादन ऊर्जा ऋणात्मक है तो अंतर्निहित ऊर्जा धनात्मक होगी और इसके विपरीत यदि उत्पादन उष्मा धनात्मक हो, तो अंतर्निहित ऊर्जा ऋणात्मक होगी। उदाहरणत: कार्बन डाइऑक्साइड तथा कार्बन डाइसलफाइड की अंतर्निहित ऊर्जाएँ क्रमानुसार -94,300 तथा +22,000 कैलरी के बराबर होंगी।
दहन-उष्मा-किसी तत्व यो यौगिक की 1 ग्राम-अणु मात्रा को ऑक्सीजन में स्थिर आयतन पर पूर्णतया जलाने से उष्मा की जो मात्रा क्षेपित होती है, उसे उस तत्व या यौगिक की दहन-उष्मा कहते हैं।
उदाहरण के लिए निम्नलिखित समीकरण से स्पष्ट है कि मेथेन की दहन-उष्मा 2,12,800 कैलरी है :
CH2 + 2 O2 = C O2 + 2H2 O + 2,12,800 क0
कार्बन को ऑक्सीजन में जलाने पर दो यौगिकों का बनना संभव है-
C + O2 = C O2 + 49,900 क0
C + O2 = C O + 26,000 क0
यह बात ध्यान देने योग्य है कि कार्बन की दहन-उष्मा 94,300 कैलरी है, 26,000 कैलरी नहीं, क्योंकि प्रथम क्रिया में ही कार्बन पूर्णतया जलता या आक्सीकृत होता है। दूसरी क्रिया में कार्बन, कार्बन मोनोक्साइड में परिवर्तित हो गया है, परंतु अभी उसका दहन पूर्ण नहीं हुआ क्योंकि कार्बन मोनोक्साइड का और दहन करके उसे कार्बन डाइऑक्साइड में आक्सीकृत किया जा सकता है।
दहन-उष्मा ज्ञात करने के लिए एक विशेष प्रकार के कलरीमापक का उपयोग किया जाता है जिसे बम-कलरीमापक (बॉम्ब कैलोरिमीटर) कहते हैं। वैज्ञानिक बरथेलों ने इसे सर्वप्रथम 1881 में बनाया था। यह गनमेटल इस्पात का बना रहता है और बेलन के आकर का होता है। इसके आंतरिक तल पर एक विशेष प्रकार का इनैमल चढा रहता है, जिससे उसपर ऑक्सीजन की कोई क्रिया नहीं होती। ढक्कन ढ को दृढ़ता से बंद करने के लिए इसमें मजबूत पेंच लगे रहते हैं। जिस पदार्थ की दहन-उष्मा निकालना हो उसकी एक निश्चित मात्रा प्लैटिनम की प्याली 'प' में ले ली जाती है और बम में लगभग 20-25 वायुमंडलीय दाब पर ऑक्सीजन भर लेते हैं। इसके बाद वम को दृढ़ता से बंद करके उसे साधारण कलरीमापक में रखते हैं। साधारण कलरीमापक में जल की एक निश्चित मात्रा ले ली जाती और प्रयोग द्वारा पहले ही यह निर्धारित कर लिया जाता है कि इस कलरीमापक में जल के ताप को 1° सेंटीग्रेड बढ़ाने के लिए कितनी उष्मा की आवश्यकता होती है। बाह्य कलरीमापक में जल का ताप नाप लिया जाता है। अब प्लैटिनम के तारों अ तथा अ द्वारा लोहे के एक महीन तार त में विद्युत् प्रवाहित करते हैं। विद्युत्प्रवाह से तार त गरम होकर लाल हो जाता है और प्याली प में रखा पदार्थ आक्सीकृत होने लगता है। लोहे के तार के जलने में तथा आक्सीकरण की इस क्रिया में उष्मा क्षेपित होती है, जिसकी मात्रा बाह्य कलरीमापक में उपस्थित जल के ताप में वृद्धि से ज्ञात कर ली जाती है। इस प्रयोग से प्राप्त उष्मा-मात्रा में से लोहे के ज्वलन में क्षेपित उष्मा को घटाकर पदार्थ के दहन द्वारा क्षेपित उष्मा की मात्रा ज्ञात की जा सकती है। स्पष्ट है कि इस प्रयोग में मंडल का आयतन स्थिर रहता है; अतएव इस विधि से किसी पदार्थ की दहन-उष्मा निर्धारित की जा सकती है।

चित्र 1. बरथेली का बम-कलरीमापक
शिथिलीकरण-उष्मा-एक ग्राम-तुल्य मात्रा क्षार को एक ग्राम-तुल्य मात्रा अम्ल द्वारा शिथिल (न्यूट्रैलाइज़) करने पर उष्मा की जो मात्रा लेपित होती है उसे शिथिलीकरण-उष्मा कहते हैं। यदि अम्ल तथा क्षार इतने तनु विलयनों में लिए जाएँ कि वे पूर्णतया आयनों में विघटित हों तो शिथिलीकरण की क्रिया केवल हाइड्रोजन तथा हाइड्रोक्सिल आयनों के संयोग से अविघटित अणु बनने की क्रिया होगी। अतएव तनु विलयनों में सब प्रबल (स्ट्रॉङ्ग) अम्लों द्वारा प्रबल क्षारों के शिथिलीकरण की उष्मा समान होगी। प्रयोग द्वारा इस उष्मा का मान 13,7000 कैलरी आता है। अत: प्रबल अम्लों द्वारा प्रबल क्षार के शिथिलीकरण को निम्नलिखित समीकरणों द्वारा व्यक्त कर सकते हैं :
HX + MOH = MX + H2O
जहाँ X को मूलक है और M कोई धातु है,
अर्थात् H+ + X+ + M+ + OH- = MX + H2O
अर्थात् H+ + OH- = H2O
परंतु यदि अम्ल या क्षार दुर्बल हो, तो वह तनु विलयन में भी पूर्णतया विघटित न होगा। अतएव ऐसे अम्लों या क्षारों की शिथिलीकरण उष्मा 13,700 कैलरी न आएगी। उदाहरण के लिए अमोनियम हाइड्रॉक्साइड की आयनीकरण-उष्मा (1 ग्राम-अणु के आयनीकरण की उष्मा) -1,500 कैलरी है, अतएव अमोनियम हाइड्रॉक्साइड तथा किसी प्रबल अम्ल (जैसे हाक्लो) की शिथिलीकरण उष्मा (13,700-1,500) =12,200 कैलरी होगी।
प्रयोग द्वारा शिथिलीकरण उष्मा को निर्धारित करने के लिए साधारणत: एक थरमस फ्लास्क में क्षार के तनु विलयन की एक निश्चित मात्रा लेकर फ्लास्क को स्थिर तापवाले जल में डुबाकर रखते हैं, जिससे विकिरण (रेडिएशन) द्वारा फ्लास्क के भीतर विलयन के ताप में अंतर न हो। अब बनु विलयन में अम्ल की समतुल्य मात्रा लेकर उसका ताप क्षार के ताप के बराबर स्थिर कर लेते हैं। अम्ल का ताप स्थिर हो जाने पर उसे शीघ्रता से क्षार में मिला देते हैं। काच के एक विलोडक (स्टरर) द्वारा विलयन को चलाकर उसका उच्चतम ताप नाप लिया जाता है। अब यदि मिश्र विलयन की मात्रा, उसकी विशिष्ट-उष्मा (स्पेसिफ़िक हीट), ताप, प्रयुक्त फ्लास्क की उष्माधारिता (हीट-कैपेसिटी) ज्ञात हो, तो शिथिलीकरण क्रिया में क्षेपित उष्मा की मात्रा सुगमता से ज्ञात की जा सकती है। इसी विधि द्वारा लवणों की विलयन-उष्मा भी सुगमता से निकाल सकते हैं।
हेस का नियम-उष्मा-रसायन का सबसे प्रमुख नियम स्विस वैज्ञानिक जरमेन हेनरी हेस ने सन् 1840 में प्रतिपादित किया था। इस नियम के अनुसार किसी रासायनिक क्रिया में क्षेपित या शोषित उष्मा की मात्रा मध्यवर्ती क्रियाओं पर निर्भर नहीं रहती, अर्थात् एक ही क्रिया को यदि एक से अधिक विधियों द्वारा पूरा किया जा सके, प्रतिकारक तथा क्रियाफल प्रत्येक क्रिया में पूर्णतया एक हों और उन सबकी अवस्थाएँ भी समान हों, तो विभिन्न विधियों में जो कुल उष्मा-परिवर्तन होगा, वह हर एक विधि के लिए समान होगा।
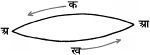
इस नियम की सत्यता संलग्न चित्र 2. से स्पष्ट है। मान लें, पदार्थ 'अ' को आ में परिवर्तित करने के लिए मार्ग आ क अ तथा आ ख अ द्वारा जाने पर क्रमानुसार क1 तथा क2 कैलरी उष्मा क्षेपित होती है। यदि क1 क मान क2 से अधिक है, तो मार्ग आ क अ द्वारा आ को अ में परिवर्तित कर और पुन: अ को आ में मार्ग अ ख आ द्वारा बदलकर (क1-क2) कैलरी उष्मा उत्पादित की जा सकती है। परंतु यह ऊर्जा-अविनाशता नियम के विरुद्ध होगा, क्योंकि बिना किसी कार्य के मंडल (सिस्टम) में उष्मा उत्पादित करना असंभव है; अर्थात् (क1-क2) का मान सर्दव शून्य होगा; अत: क1 सदैव क2 के बराबर होगा।
इस नियम की सत्यता देखने के लिए निम्नांकित उदाहरण को ले सकते हैं। अमोनिया तथा हाइड्रोजन क्लोराइड गैसों की प्रतिक्रिया से अमोनियम क्लोराइड विलयन दो प्रकार से प्राप्त किया जा सकता है :
प्रथम विधि
NH3 (गैस) + HCl (गैस) = NH4Cl (गैस) + 42,100 क0
NH4Cl (गैस) + जल = NH4Cl (जलीय) - 39,900 क0
NH3 (गैस) + HCl (गैस) + जल = NH4Cl (जलीय) + 38,200 क0
द्वितीय विधि
NH3 (गैस) + जल = NH3 (जलीय) + 8,400 क0
HCl (गैस) + जल = HCl (जलीय) - 17,500 क0
NH3 (जलीय) + HCl (जलीय) = NH4Cl (जलीय) + 12,300 क0
NH3 (गैस) + HCl (गैस) + जल = NH4Cl (जलीय) 38,200 क0
उपर्युक्त उदाहरण से हेस के नियम की सत्यता स्पष्ट हो जाती है।
हेस का नियम उष्मा-रसायन में बहुत उपयोगी सिद्ध हुआ है। इसकी सहायता से प्रत्यक्ष रूप से न की जा सकनेवाली प्रतिक्रियाओं में होनेवाले उष्मा-परिवर्तनों को भी परोक्ष रूप से निकाला जा सकता है। उदाहरण के लिए; साधारणत: कार्बनिक यौगिकों की उत्पादन-उष्मा प्रत्यक्ष क्रिया द्वारा नहीं निकाली जा सकती, परंतु कार्बनिक यौगिक तथा इसके अवयव तत्वों की दहन-उष्मा को निर्धारित करके यौगिक की उत्पादन-उष्मा हेस के नियम से निकाल सकते हैं।
उदाहरण के लिए मेथेन, कार्बन तथा हाइड्रोजन की दहन-उष्मा क्रमानुसार 2,12,800; 94,400 तथा 68,400 कैलरी आती है, अर्थात्
CH4 + 2O2 = C O2 + 2H2 O + 2,12,800 क0
C + O2 = C O2 + 94,300 क0
H2 + O2 = H2 O + 68,400 क0
द्वितीय समीकरण में तृतीय समीकरण का दुगुना जोड़कर प्रथम समीकरण को घटाने पर निम्नलिखित समीकरण प्राप्त होगा :
C + O2 = 2H 2 + O2 -CH4 - 2O2 = C O2 + 2H2 O -C O2
- 2H2 O + (94,300 + 2 ´ 68,400 - 2,12,80000)
अर्थात् C + 2H 2 = CH4 + 18,3000 क0
उपर्युक्त विवेचन से स्पष्ट है कि मेथेन उत्पादन-उष्मा 18,400 कैलरी है। इस प्रकार हेस के नियम के अंर्तगत उष्मारासायनिक समीकरणों को गणित के समीकरणों की भाँति गुणा कर, विभाजित कर, जोड़कर या घटाकर अभीष्ट प्रतिक्रिया का समीकरण तथा उस क्रिया में होनेवाले उष्मा-परिवर्तन के मान का पता लगा लेते हैं।
श्
तालिका 1
प्रत्यक्ष संश्लेषण विधि से कुछ पदार्थों की उत्पादन-उष्मा
यौगिक किलोकलरी/ग्राम-अणु यौगिक किलोकलरी/ग्राम-अणु
H2o (द्रव) -68.317 ±0.010 HFl (गैस) -64.2
CO2 (गैस) -94.052 ±0.011 HCl (गैस) -22.063 ± 0.012
SiO2 (क्वार्ट्ज़) -210.3 ±0.3 BCll3 (गैस) -97.5 ± 0.300
Al2O3 -400.3 ±0.3 H Br (गैस) -8.707 ± 0.130
SnO2 -138.8 ±0.1 Ti3Br4 (द्रव) -148.1 ± 0.300
ThO2 -293.2 ±0.2 AIN -57.4 ± 1.300
तालिका 2
परोक्ष विधियों से प्राप्त कुछ पदार्थों की उत्पादन-उष्मा
योगिक किलोकलरी/ग्राम-अणु योगिक किलोकलरी/ग्राम-अणु
EtCl (गैस) -26.2 ±0.5 Si (OEt) -330.2
EtBr (गेस) -15.3 ±0.5 CH3COCl -65.1
CH4 (गैस) -17.889 CH2CONH2 -78.7
C2H6 (गैस) -20.326 CH2COOEt -114.9
C2H6 (गैस) 19.82 CdMe2 16.7 ±0.5
BCl3 (द्रव) -10.26 HgPh2 65.4 ±2
उष्मारसायन के औद्योगिक उपयोग-रासायनिक क्रियाओं से प्राप्त ऊर्जा ही हमारे उद्योगों को चलाने का साधन रही है। आज कृत्रिम उपग्रह के युग में जब मानव चंद्रमा तथा अन्य ग्रहों की यात्रा में प्रयत्नशील है तो ऐसे ईधनों की खोज आवश्यक हो गई है जिनकी सूक्ष्म से सूक्ष्म मात्रा अधिक तम ऊर्जा दे सके। बोरन यौगिक इस ओर बहुत उपयोगी सिद्ध हो रहे हैं, क्योंकि समान मात्रा में कार्बन यौगिकों से उनकी दहन-उष्मा अधिक होती है और वे हमें अधिक ऊर्जा देने में सफल होते हैं।
उष्मारसायन के अन्य उपयोग बहुत काल से होते आए हैं। उदाहरण के लिए ;प्रथम तालिका में ऐल्यूमिनियम औक्साइड की उत्पादन-उष्मा सबसे अधिक दिखाई गई है। इसी गुण का उपयोग गोल्डडश्मिट की उष्मन विधि (थर्मिट प्रोसेस) में किया गया है। ऐल्यूमिनियम ऑक्साइड की उत्पादन-उष्मा इतनी अधिक होने के कारण प्रतिक्रिया,
8 Al + 3 Fe3 O4® 9 Fe + 4 Al2 O3
में इतनी अधिक उष्मा क्षेपित होती है कि मंडल का ताप लगभग 3,0000 सेंटीग्रेड तक पहुँच जाता है और लोहा तक पिघल जाता है। इस प्रकार टूटी हुई रेल की पटरियों भी भारी मशीनों के टूटे हुए भागों को उपर्युक्त क्रिया की सहायता से पिघलाकर जोड़ा जा सकता है।[1]
|
|
|
|
|
|
टीका टिप्पणी और संदर्भ
- ↑ हिन्दी विश्वकोश, खण्ड 2 |प्रकाशक: नागरी प्रचारिणी सभा, वाराणसी |संकलन: भारत डिस्कवरी पुस्तकालय |पृष्ठ संख्या: 174 |