ऊष्मा एक प्रकार की ऊर्जा है, जो दो वस्तुओं के बीच उनके तापान्तर के कारण एक वस्तु से दूसरी वस्तु में स्थानान्तरित होती है। स्थानान्तरण के समय ही ऊर्जा ऊष्मा कहलाती है। वस्तु का ताप, वस्तु में ऊष्मा की मात्रा तथा वस्तु के पदार्थ की प्रकृति पर निर्भर करता है, जबकि किसी वस्तु में निहित ऊष्मा उस वस्तु के द्रव्यमान व ताप पर निर्भर करती है। ऊष्मा एक प्रकार की ऊर्जा है, जिसे कार्य में बदला जा सकता है। इसका प्रत्यक्ष प्रमाण सबसे पहले रमफोर्ड ने दिया। बाद में डेवी ने दो बर्फ़ के टुकड़े को आपस में घिसकर पिघला दिया। चुँकि बर्फ़ को पिघलने के लिए ऊष्मा का और कोई स्रोत नहीं था, अतः यह माना गया कि बर्फ़ को घिसने में किया कार्य बर्फ़ पिघलने के लिए ली गई आवश्यक ऊष्मा में बदल गया। बाद में जूल ने अपने प्रयोगों से इस बात की पुष्टि की कि "ऊष्मा ऊर्जा का ही एक रूप है।" जूल ने बताया कि जब कभी कार्य ऊष्मा में बदलती है, या ऊष्मा कार्य में बदलती है, तो किए गए कार्य व उत्पन्न ऊष्मा का अनुपात एक स्थिरांक होता है, या ऊष्मा का यांत्रिक तुल्यांक कहते हैं तथा इसको पार्स नहीं कर पाये (सर्वर 'https://api.formulasearchengine.com/v1/' से अमान्य लेटेक्सएमएल उत्तर ('Math extension cannot connect to Restbase.')): {J} से सूचित करते हैं। उष्मा (अंग्रेजी में हीट) की प्रकृति का अध्ययन तथा पदार्थों पर उसका प्रभाव जितना मानव हित से संबंधित है उतना कदाचित् और कोई वैज्ञानिक विषय नहीं। उष्मा से प्राणिमात्र का भोजन बनता है। वसंत ऋतु के आगमन पर उष्मा के प्रभाव से ही कली खिलकर फूल हो जाती है तथा वनस्पति क्षेत्र में एक नए जीवन का संचार होता है। इसी के प्रभाव से अंडे से बच्चा बनता है। इन कारणों से यह कोई आश्चर्य की बात नहीं कि पुरातन काल में इस बलवान्, प्रभावशील तथा उपयोगी अभिकर्ता से मानव प्रभावित हुआ तथा उसकी पूजा और अर्चना करने लगा। कदाचित् इसी कारण मानव ने सूर्य की पूजा की। पृथ्वी पर उष्मा के लगभग संपूर्ण महत्वपूर्ण प्रभावों का स्रोत सूर्य है। कोयला, तेल, पेट्रोल, जिनसे हमें उष्मा प्राप्त होती है, प्राचीन युगों से संचित धूप का प्रतिनिधित्व करते हैं।
इतिहास-उष्मा के सामान्य प्रभावों का स्पष्टीकरण करने के हेतु अग्नि-परमाणुओं का अविष्कार किया गया, जो पदार्थ के रध्राेंं के बीच प्रचंड गति से दौड़ते हुए तथा उसके अणुओं को तितर-बितर करते हुए माने गए थे। विचार था कि इसके फलस्वरूप ठोस पदार्थ द्रव में तथा द्रव वाष्प में परिवर्तित होते हैं।
विज्ञान के आरंभिक युग से लेकर वर्ममान शताब्दी के प्रारंभ तक उष्मा की प्रकृति के संबंध में दो प्रतिद्वंद्वी परिकल्पानएँ साधारणतया चली आई हैं। एक तो है उषिक सिद्धांत (कैलोरिक थ्योरी) जिसके अनुसार उष्मा को एक अति सूक्ष्म लचीला द्रव माना गया था जो पदार्थो के रध्राेंं में प्रवेश करके उनके अणुओं के बीच के स्थान को भर लेता है। दूसरा है प्राचीन यूनानियों द्वारा चलाया गया सिद्धांत जिसमें उष्मा के आधुनिक सिद्धांत का अंकुर पाया जाता है। इसके अनुसार उष्मा पदार्थ के कणों के द्रुत कंपन के कारण होती हैं; अत: इस मत के अनुसार उष्मा का कारण गति है। इस सिद्धांत के पोषक बहुत दिनों तक अल्प मत में रहे।
प्रेक्षण पर आधारित सिद्धांत की रचना में प्रथम प्रयत्न लार्ड बेकन ने किया तथा वे इस परिणाम पर पहुँचे कि उष्मा गति हैं। इंग्लैंड में उनके अनुयायियों के मत से यह 'गति' पदार्थ के अणुओं की थी। परंतु यूरोप के अधिकतर वैज्ञानिकों के मतानुसार यह एक अतिसूक्ष्म तथा लचीले द्रव के कणों की मानी गई जो पदार्थ के रध्राेंं में अंत: प्रविष्ट होकर उसके कणों के बीच स्थित माना गया था।
उषिक सिद्धांत-उषिक सिद्धांत के अनुसार उष्मा का कारण एक अति लचीले स्वप्रतिकर्षक तथा सर्वव्यापी द्रव की क्रिया था। इस द्रव के गुण ये माने गए : यह अति लचीला था तथा इसके कण परस्पर प्रतिकर्षण करते थे। इस द्रव को 'कैलरिक' नाम दिया गया। प्रतिकर्षण गुण के कारण जलने पर यह द्रव उष्मा तथा प्रकाश उत्पन्न करता हुआ माना गया। 'कैलरिक' के कण परस्पर तो प्रतिकर्षक थे परंतु साधारण पदार्थ के कणों से आकर्षित होते माने गए। विभिन्न पदार्थो के कण उसे विभिन्न बल से आकर्षित करते थे। यह द्रव अनाश्य तथाश् अजन्मा माना गया।
उषिक सिद्धांत के अनुसार पदार्थ 'कैलरिक' की वृद्धि से उष्ण होता था तथा उसके ्ह्रास से शीतल। पदार्थ पर उष्मा के भिन्न भिन्न प्रभावों को कैलरिक सिद्धांत के अनुसार स्पष्टीकरण के प्रयत्न होते रहे। कुछ का तो स्पष्टीकरण सरलता से हो गया परंतु कुछ के लिए अन्य अनेक कल्पानएँ करनी पड़ीं।
घर्षण द्वारा उष्माजनन की घटना मानव को आदिकाल से ज्ञात है। कैलरिक सिद्धांत के अनुसार इसके स्पष्टीकरण के प्रयत्न किए गए, परंतु वे संतोषप्रद न हो सके।
उष्मागतिकी-घर्षण द्वारा उष्मा के उद्भव में एक विशेषता यह है कि पदार्थों का जितना अधिक घर्षण किया जाता है उतनी अधिक मात्रा में उष्मा निकलती है, अत: इस रीति से अनंत मात्रा में उष्मा मिल सकती है। इसका स्पष्टीकरण कैलरिक मत से नहीं हो सकता जिसके अनुसार प्रत्येक पदार्थ में सीमित मात्रा में उष्मा-द्रव रहता है। वस्तुत: यह कार्य तथा उससे उत्पन्न उष्मा के विषय में जूल ने महत्वपूर्ण प्रयोग किए तथा वह यह सिद्ध करने में सफल हुआ कि कार्य तथा उष्मा में तुल्यता है। जब कार्य किया जाता है तब उष्मा की उत्पत्ति होती है। यदि कार्य तथा उष्मा का मान क्रमानुसार का (W) तथा उ (H) है तो का=जू उँ (W=JH) यहाँ जू (J) स्थिर है तथा इसे उष्मा का यांत्रिक तुल्यांक कहते हैं। अत: जू (J) कार्य की वहु मात्रा है जिससे एक कैलरी उष्मा उत्पन्न हो। इसका मान ४.18´107 अर्ग प्रति कैलरी है।
काउंट रूमफोर्ड ने इस विषय में यह सुझाव दिया था कि कार्य से उष्माजनन का कारण गति है। अब प्रश्न उठता है, 'किसकी गति?'
गतिज सिद्धांत-पदार्थ की रचना अणुओं तथा परमाणुओं से हुई है। पदार्थ के तीन रूप होते हैं : ठोस, द्रव तथा गैस। यदि कोई ठोस पदार्थ उष्ण किया जाए तो उसके ताप में वृद्धि होती है। एक निश्चित ताप पर पहुँचकर यह गलने लगता है तथा द्रव रूप में परिवर्तित हो जाता है। और अधिक उष्ण करने से द्रव की तापवृद्धि होती है तथा एक दूसरे निश्चित ताप पर इसका वाष्पीकरण आरंभ हो जाता है। जब संपूर्ण द्रव वाष्प में परिवर्तित हो जाता है तब इसे गैस कहते हैं।
गतिज सिद्धांत के अनुसार पदार्थ के अणु शाश्वत गति की अवस्था में रहते हैं। अणु की गति पदार्थ के ताप पर निर्भर रहती है। पदार्थ जितना अधिक उष्ण होता है उतनी ही अधिक प्रचंड गति उसके अणुओं में होती है। ठोस पदार्थ में अणु एक मध्यक स्थिति के चारों ओर प्रदोलन करता है। तापवृद्धि से अणुप्रदोलन में वृद्धि होती है तथा अंत में प्रदोलन इतना प्रचंड हो जाता है कि अणु अपने स्थान से पृथक-पृथक होकर इधर उधर अन्य अणुओं के स्थानों पर चला जाता है तथा अपनी नवीन स्थिति में प्रचंडता से प्रदोलन करने लगता है। इस अवस्था में अणुओं की परस्पर आकर्षण शक्ति, जो उनको अपने स्थानों पर रखती है, इतनी मंद हो जाती है कि तनिक-सी ठेस लगने से पदार्थ का रूप परिवर्तित हो जाता है। इस अवस्था को पदार्थ की तरल अवस्था कहते हैं। अतएव तरल अवस्था में अणुओं में दोलन के साथ-साथ रैखिक गति भी होती है। ठोस अवस्था के अणुओं में दोलन क्रिया को प्रचंड करने में तथा उनमें रैखिक गति उत्पन्न करने में उष्मा की आवश्यकता होगी। यह उष्मा गलन कीश् गुप्त उष्मा के तुल्य होती है।
अब यदि हम द्रव पदार्थ का क्रमश: तापन करें तो आणविक ऊर्जा में वृद्धि होगी तथा द्रवपृष्ठ के निकट आते हुए किसी अणु की गति इतनी तीव्र हो सकती है कि वह आसपास के अन्य अणुओं के आकर्षण का निराकरण करके द्रव को छोड़कर उसके ऊपर के स्थान में चला जाए। इस प्रकार प्रक्षिप्त अणुओं का एक अंतत: जब संपूर्ण अणु द्रव को छोड़ देते हैं तो वह गैस में परिवर्तित हो जाता है।
गैस अवस्था में अणु सरल रेखाओं में चलते हैं तथा परस्पर टकराते पर उनकी गति तथा दिशा में परिवर्तन होता है। दो अनुगामी टक्करों के बीच का मुक्त पथ सरल रेखीय तथा अति न्यून होता है। इस पथ पर चलतु हुए द्रव अवस्था से गैस अवस्था में परिवर्तन होने के लिए अणुओं को अपने पारस्परिक आकर्षण के विरुद्ध पृथक होना पड़ता है। इसके लिए कार्य की आवश्यकता होती है तथा यह कार्य वाष्पीकरण की गुप्त उष्मा के तुल्य होता है।
विकिरण-उष्मा का तरंगवाद-घर्षण तथा संघट्टन (टकराने) से वस्तुओं की इंद्रियग्राह्य शक्ति का लोप हो जाता है तथा उष्मा का जनन होता है। यह कल्पना है कि इन घटनाओं में गति का क्षय नहीं होता वरन् वह केवल संपूर्ण वस्तु से उसके प्रत्येक कण में स्थानांतरित होती है। अत: जब एक गतिशील वस्तु घर्षण अथवा संघट्टन द्वारा रोकी जाती है तो वस्तु की मौलिक दृश्य गति का अंत नहीं होता; परंतु वह उस वस्तु के अदृश्य अणुओं तथा परमाणुओं में चली जाती है।
किसी तप्त वस्तु से कुछ दूरी पर हमें उष्णता का आभास होता है। यह उष्मा वस्तु से हम तक कैसे आई? सूर्य पृथ्वी के समस्त उष्मिक प्रभावों का स्रोत है। सूर्य से प्रकाश तथा उष्मा दोनों ही आते हैं। प्रकाश व्योम (ईथर) में तरंगगति के कारण होता है, ऐसी कल्पना है। इस कल्पना की पुष्टि में प्रमाण हैं। इसी प्रकार उष्मा भी व्योम में तरंगगति के कारण होती है। विकिरण उष्मा, उदाहरणतया धातु के एक तप्त खंड से उत्सर्जित उष्मा तथा प्रकाश के आचरण यथार्थत: एक समान होते हैं। इन दोनों में वास्तविक अंतर, जिसका उपलंभन हो सकता है, यह है, कि प्रकाश में विकीर्ण उष्मा के समस्त लक्षणों के अतिरिक्त दृष्टि की अनुभूति को प्रभावित करने का लक्षण भी होता है।
अत: प्रकाश के समान विकीर्ण उष्मा भी व्योम में तरंगगति के कारण मानी जाती है। एक तप्त पदार्थ के अणु तीव्र गति की अवस्था में होते हैं अथवा किसी द्रुत-आवर्ती विक्षोभ के केंद्र होते हैं तथा वे व्योम में तरंगें प्रदीप्त करते हैं जो हमारे तथा तप्त वस्तु के मध्य प्रकाशगति से चलती हैं। जब वे हमारे ऊपर गिरती हैं तो शरीर द्वारा शोषित हो जाती हैं तथा हमारे शरीर के अणुओं में तदनुरूप गति का कारण होती हैं। इस प्रकार हमें उष्णता का बोध होता है। अत: उष्णता का बोध तप्त पदार्थ से अपसारित व्योमतरंगों के कारण उसी प्रकार होता है, जिस प्रकार दीप्त पदार्थ से चक्षु तथा एक ध्वनित वस्तु से वायुतरंगों द्वारा कान प्रभावित होता है।
किसी स्थान पर स्थित पदार्थ व्योम के सतत क्षोभ का स्रोत माना जाता है। पदार्थ का प्रत्येक कण कंपन करते हुए व्योम में तरंगों का जनन करता है। अत: हम सदैव चारों ओर से आती हुई विकिरणतरंगों में डूबे रहते हैं। इन तरंगों द्वारा हमें दृष्टि तथा उष्मा का बोध होता है। यदि यह तरंग निश्चित आवृत्तिसीमाओं के बीच की है तो उससे चक्षु प्रभावित होता है तथा इसे हम प्रकाशतरंग कहते हैं। यह तरंग हमारे शरीर के अणुओं में विक्षोभ भी उत्पन्न कर सकती है और इस कारण हमें उष्णता का बोध कराती है। मंद कंपन की तरंगें चक्षुओं को प्रभावित नहीं करतीं, वे केवल शरीर को उष्ण करती हैं। इन्हें अवरक्त किरणें (इनफ्रा-रेड रेज़) कहते हैं। द्रुत कंपन की तरंगें चक्षु को प्रभावित कर प्रकाश का बोध देती हैं, उनसे उष्णता का बोध नहीं के समान होता है। इन्हें हम दृश्य प्रकाशतरंग कहते हैं।
इस संबंध में अग्रलिखित लेख भी देखें : उष्मागतिकी, उष्मामिति, उष्मायन, ऊर्जा, क्वांटम यांत्रिकी, क्वांटम सांख्यिकी, तापमापन, तापविद्युत्, वाष्पायन, विकिरण।
1. मापनी-शीतोष्णता का अनुभव प्राणियों की स्पर्शेद्रिय का स्वाभाविक गुण है। इस अनुभव को मात्रात्मक रूप में व्यक्त करने के लिए एक पैमाने की आवश्यकता पड़ती है जिसको तापक्रम (स्केल ऑव टेंपरेचर) कहते हैं। अपेक्षाकृत अधिक गरम प्रतीत होनेवाली वस्तु के विषय में कहा जाता है कि उसका ताप (टेंपरेचर) अधिक है। पदार्थों में तापवृद्धि का कारण यह होता है कि उनमें ऊर्जा (एनर्जी) के एक विशेष रूप, उष्मा की वृद्धि हो जाती है। उष्मा सदैवश् ऊँचे तापवाले पदार्थों से निम्न तापवाले पदार्थों की ओर प्रवाहित होती है और उसकी मात्रा पदार्थ के द्रव्यमान (मास) तथा ताप पर निर्भर रहती है।
2. तापक्रम-छूने से ताप का जो ज्ञान प्राप्त होता है वह मात्रात्मक और विश्वसनीय नहीं होता। इसी कारण इस कार्य के लिए यांत्रिक उपकरण प्रयुक्त होते हैं जिनको तापमापी अथवा थर्मामीटर कहते हैं। सर्वसाधारण में जिन थर्मामीटरों का प्रचार है उनमें शीशे की एक छोटी खोखली घुंडी (बल्ब) होती है जिसमें पारा या अन्य द्रव भरा रहता है। बल्ब के साथ एक पतली नली जुड़ी रहती है। तापीय प्रसरण (थर्मल एक्स्पैंशन) के कारण द्रव नली में चढ़ जाता है और उसके यथार्थ स्थान से ताप की डिग्री का बोध होता है। इस प्रकार के थर्मामीटर 165४ ई. के लगभग फ़्लोरेन्स में टस्कनी के ग्रैंड डयूक फ़र्डिनैंड ने प्रचलित किए थे। तापक्रम निश्चित करने के लिए इन थर्मामीटरों को सर्वप्रथम पिघलते हुए शुद्ध हिम (बरफ) में रखकर नली में द्रव की स्थिति पर चिह्न बना देते हैं। सेंटीग्रेड पैमाने में हिमांक को शून्य मानते हैं तथा इसके और क्वथनांक के बीच की दूरी को 100 बराबर भागों में बाँट देते हैं जिनमें से प्रत्येक को डिग्री कहते हैं। आजकल इस पैमाने को सेलसियस पैमाना कहते हैं। फारेनहाइट मापक्रम में पूर्वोक्त हिमांक को32° और रोमर में शून्य डिग्री मानते हैं किंतु फारेनहाइट में पूर्वोक्त हिमांक और जल के क्वथंनाक की दूरी 180 भागों में और रोमर में 80 भागों में विभक्त की जाती है।
यदि दो भिन्न द्रवों से थर्मामीटर बनाकर उपर्युक्त विधि से अंकित किए जाएँ तो हिमांक और क्वथनांक को छोड़कर अन्य तापों पर सामान्यत: उनके पाठयांकों में भेद पाया जाएगा। अत: केवल उष्मागतिकी (द्र.) अंकों को उसी के अनुसार शुद्ध कर लेते हैं। इस पैमाने को परम ताप (ऐब्सोल्यूट टेंपरेचर) अथवा केल्विन मापक्रम भी कहा जाता है और इसके पाठयांक अंग्रेजी में T से व्यक्त किए जाते हैं। यहाँ तथा उष्मागतिकीश् शीर्षक लेख में परम ताप को पा या T से सूचित किया गया है। यह कार्नो चक्र पर आधारित है और इसका शून्य परमश् शून्य होता है जिसका मान-273.2°श् सें. है और जिससे न्यूनतर ताप संभव नहीं हो सकता।
पूर्वोक्त शीशे-के-भीतर-द्रववाले तापमापियों की उपयोगिता सीमित ही होती है।300° सें.से ऊपर प्राय: विद्युतीय प्रतिरोध और ताप विद्युतीय (थर्मोइलेक्ट्रिक) थर्मामीटर प्रयुक्त होते हैं। अति उच्च ताप के मापनार्थ केवल विकिरण सिद्धांतों पर आधारित उत्तापमापियों (पायरोमीटरों) का प्रयोग होता है। शून्य डिग्री सेंटीग्रेड से नीचे गैस थर्मामीटर, विद्युतीय प्रतिरोध थर्मामीटर, हीलियम-वाष्प-दाब थर्मामीटर, और परम शून्य के निकट चुंबकीय प्रवृत्ति (मैगनेटिक ससेप्टिबिलिटी) पर आधारित थर्मामीटर प्रयुक्त होते हैं। इन सब तापमापियों के अंक या तो आदर्श गैस थर्मामीटरों से मिलाकर शुद्ध किए जाते हैं अथवा इनके शोधन के लिए उष्मागतिकी के सिद्धांतों का आश्रय लिया जाता है। (विशेष विवरण के लिए तापमापन शीर्षक लेख द्र.।)
3. अवस्थापरिवर्तन उष्मा के प्रभाव से पदार्थों में परिवर्तन किया जा सकता है और कुछ अस्थायी यौगिकों को छोड़कर सब का अस्तित्व गैस, द्रव और ठोस, इन तीनों रूपों में संभव है। सामान्य वायुमंडलीय दाब पर द्रव का ठोस अथवा वाष्प में परिवर्तन निश्चित तापों पर होता है जिनको हिमांक और क्वथनांक कहते हैं। उपर्युक्त दाब पर यदि एक ग्राम पदार्थ का अवस्थापरिवर्तन किया जाए तो उष्मा की एक निश्चित मात्रा या तो उत्पन्न अथवा शोषित होती है। इसको गुप्त उष्मा (लेटेंट हीट) कहते हैं। ताप की उचित वृद्धि होने पर सब ठोस द्रव में बदल जाते हैं और इसी प्रकार गैसों को निम्नलिखित विधियों से द्रवों में और उसके उपरांत ठंडा करने पर ठोसों में बदला जा सकता है। ठोस के रूप में बदली जानेवाली अंतिम गैस हीलियम है जिसको ठोस बनाने के लिए द्रव को ठंडा करने के साथ ही उसपर अत्यधिक दाब भी लगाना पड़ता है।
प्रत्येक गैस का अपना एक क्रांतिक ताप (क्रिटिकल टेंपरेचर) होता है। यदि गैस का ताप इससे कम हो तो केवल दाब बढ़ाने से ही उसे द्रव बनाना संभव होता है, अन्यथा सर्वप्रथम ठंडा करके उसका ताप क्रांतिक ताप से नीचे ले आते हैं। द्रव के रूप में बदली जानेवाली अंतिम गैसें वायु, हाइड्रोजन और हीलियम हैं। वायु को क्रांतिक ताप के नीचे ठंडा करने के लिए जूल-टामसन-प्रभाव का उपयोग करते हैं। यदि कोई उच्च दाब की गैस महीन छेदों में से होकर कम दाब वाले भाग में निकाली जाए तो वह प्राय: ठंडी हो जाती है। इसी को जूल-टामसन-प्रभाव कहते हैं। इसकी मात्रा बहुत कम होती है। उदाहरणार्थ यदि छेद के दोनों और दाब की मात्रा क्रमानुसार 50 वायुमंडल और 1 वायुमंडल हो तो साधारण ताप ही हवा केवल 11.7° सें. ठंडी होती है। किंतु एक बार ठंडी होनेवाली गैस ऊपर उठकर आनेवाली गैस को ठंडी कर देती है। जब गैस के इस ठंडे अंश पर जूल-टामसन-प्रभाव पड़ता है तो यह और अधिक ठंडी हो जाती है कि उसका ताप क्रांतिक ताप से नीचे चला जाता है और वह केवल दाब के प्रभाव से ही द्रव में बदल जाती है। वायु के द्रवण (लीक्विफ़ैक्शन) की दो मशीनें लिंडे और क्लॉड-हाईलैंड के नाम से प्रसिद्ध हैं। प्रथम उपकरण में केवल उपर्युक्त विधि का ही प्रयोग होता है, किंतु दूसरे में इस विधि के अतिरिक्त गैस का कुछ अंश एक इंजिन के पिस्टन को चलाता है। अत: काम करने के कारण यह अंश स्वत: ठंडा हो जाता है।
साधारण ताप पर हाइड्रोजन और हीलियम ये दोनों गैसें जूल-टामसन-प्रभाव के कारण गरम हो जाती है, परंतु ताप उचित मात्रा में कम होने पर सामान्य गैसों की तरह ही ठंडी होती हैं। अत: इन गैसों को पहले ही इतना ठंडा कर लेना आवश्यक है कि इस प्रभाव का लाभ उठाया जा सके। डेबर ने 1898 में हाइड्रोजन को द्रवित वायु से ठंडा करने के पश्चात् लिंडे की उपर्युक्त विधि से द्रव में परिणत किया। ओन्स ने इसी विधि से 1908 में अंतिम गैस हीलियम का द्रवण किया, किंतु जूल-टामसन-प्रभाव का उपयोग करने से पूर्व इसको द्रव हाइड्रोजन से ठंडा कर लिया गया था।
वायुमंडलीय दाब पर हीलियम का क्वथनांक ४° पा (T) है। दाब घटाकर वाष्पन करने से 0.7° पा (T) तक पहुँचा जा सकता है। इससे भी कम ताप की उत्पत्ति स्थिरोष्म विचुंबकन (ऐडियाबैटिक डिमैगनेटिज़ेशन) द्वारा की जा सकती है। इस विधि में विशेष समचुंबकीय (पैरामैगनेटिक) लवण प्रयुक्त होते हैं। ऐसे एक लवण को चुंबकीय ध्रुवों के बीच हीलियम गैस से भरी नली में लटकाया जाता है। यह नली स्थिर ताप के हीलियम द्रव से घिरी रहती है। चुंबकीय क्षेत्र स्थापित करने पर चुंबकन-उष्मा (हीट ऑव मैगनेटिज़ेशन) को हीलियम द्रव खींच लेता है, अत: ताप स्थिर रहता है। अब नली की हीलियम गैस निकाल ली जाती है जिससे लवण का हीलियम द्रव से उष्मिक पृथक्करण (इनसुलेशन) हो जाता है। इसके उपरांत चुंबकीय क्षेत्र हटा लेते हैं। लवण का विचुंबकन हो जाता है और इस कार्य में उष्मा व्यय होने से यह स्वत: ठंढा हो जाता है। इस प्रकार ताप को लगभग 0.001° पा तक घटाया जा सकता है। नाभिकीय विचुंबकन (न्यूक्लियर डिमैग्नेटिज़ेशन) द्वारा इससे भी निम्न ताप कीश् प्राप्ति हो सकती है।
4 तापीय प्रसरण-तापवृद्धि होने पर प्राय: सब वस्तुओं के आकार में वृद्धि होती है जिसको तापीय प्रसरण कहते हैं। यदि शून्य ताप पर आयतन आ0 (V0) हो तो प° (t°) पर संनिकटत: आयतन निकालने के लिए निम्नलिखित सूत्र लागू होता है:
आप =आ0 (1+प्राप)।
vt =V° (1+bt)।
प्रा (b) को प्रसरण गुणांक कहते हैं। ताप में अधिक वृद्धि होने पर इस सूत्र में प (t) के उच्च घात (पावर) भी आते हैं। ठोसों में पूर्वोक्त प्रकार का सूत्र लंबाई के प्रसरण के लिए भी होता है जिसके गुणांक को प्र (a) से व्यक्त करते हैं और रेखीय प्रसरण गुणांक कहते हैं। यह प्रा (b) का 1/3 होता है।
गैसों और द्रवों का प्रसरण गुणांक बहुत बड़ा होता है, अत: उसका मापन अपेक्षाकृत सरल है। गैसों में दाब और आयतन दोनों का प्रसरण होता है। यदि दाब स्थिर हो तो पूर्वोक्त सूत्र आयतन पर पूर्ण रूप से लागू होता है। आयतन स्थिर होने पर इसी सूत्र में आ (V) के स्थान पर दा (P) लिखकर दाब दा का सूत्र बन जाता है। प्रा (b) दोनों सूत्रों में एक ही है और इसका मान सब आदर्श गैसोंश् में 1।273 के लगभग होता है। सब गैसें क्रांतिक ताप से बहुत ऊँचे ताप पर आदर्श गैसें होती हैं, किंतु यदि इनका क्वथंनाक निकट न हो और दाब अधिक न हो तो सामान्यत: आक्सिजन, नाइट्रोजन हाइड्रोजन ओर हीलियम को आदर्श गैसें कहते हैं। सब आदर्श गैसों पर निम्नलिखित सूत्र लागू होता है :
दा आ = झ पा,
P V = R T,
जिसमें दा (P)दाब और आ (V) आयतन है। पा (T) परम ताप है जिसकी मात्रा सेंटीग्रेड ताप में 273 जोड़ने पर प्राप्त होती है। झ (R) को गैस नियतांक कहते हैं। एक ग्राम-अणु (ग्राम-मॉलिक्यूल) गैस के लिए इसकी मात्रा लगभग दो कलरीश् अथवा 8.3 जूल होती है।
ठोसों का प्रसरण गुणांक बहुत कम होता है, अत: इसके मापन मे विशेष विधियाँ प्रयुक्त होती हैं। माणिभ (क्रिस्टल) बहुत छोटे होते हैं, अत: उनके प्रसरण का मापन और भी दुष्कर होता है। एक उदाहरण में क्रिस्टल पट्टिका और सिलिका की पट्टिका के बीच में प्रकाशीय व्यतिकरण धारियाँ (ऑप्टिकल इंटरफ़ियरेन्स फ्रंजेज़) उत्पन्न की जाती हैं। तापवृद्धि से धारियाँ स्थानांतरित हो जाती हैं जिसके मापन से गुणांक निकाला जा सकता है। उच्च सम्मिति (सिमेट्री) के क्रिस्टलों को छोड़कर अन्य क्रिस्टलों के प्रसरणगुणांक दिशा के अनुसार भिन्न होते हैं। ठोसों के संबंध में ग्रीनाइज़न का यह नियम है कि प्रत्येक धातु का प्रसरण गुणांक उसकी स्थिर दाबवाली विशिष्ट उष्मा का समानुपाती होता है।
5. कलरीमिति-एक ग्राम पानी का ताप 1४.5°श् सें. से 15.5°श् सें. तक बढ़ाने में जितनी उष्मा की आवश्यकता होती है उसे एक कलरी कहते हैं। अन्य ताप पर पानी की 1° श्तापवृद्धि के लिए इससे कुछ भिन्न मात्रा की आवश्यकता होती है, पर दोनों का अंतर कभी भी 1/2 प्रतिशत से अधिक नहीं होता। किसी 1 ग्राम वस्तु में 1° सें. तापपरिवर्तन करनेवाली उष्मा को उसकी विशिष्ट उष्मा (स्पेसिफ़िक हीट) कहते हैं। विशिष्ट उष्मा वि (S) की किसी वस्तु के द्रव्यमान द्र (m) ग्राम का ताप प (t) डिग्री सें. बढ़ाने में द्र वि प (mSt ) कलरियाँ व्यय होती हैं। किसी वस्तु की विशिष्ट उष्मा ज्ञात करने के लिए सर्वप्रथम उसको ऊँचे ताप तक गरम करते हैं और फिर उसको एक आंशिक रूप से पानी भरे बरतन (कलरीमापी) में डाल देते हैं। वस्तु के ठंडी होने में जितनी कलरियाँ मिलीं उनको कलरीमापी और पानी द्वारा प्राप्त कलरियों के बराबर रखकर विशिष्ट उष्मा की गणना कर लेते हैं।
विशिष्ट उष्मा निकालने की एक अन्य विधि यह भी है कि पदार्थ के ऊपर इतनी भाप को प्रवाहित करें कि उसका ताप बढ़कर भाप के ताप के बराबर हो जाए। यदि इस विधि में द्र (m) ग्राम भाप संघनित (कनडेन्स) होती है तो उसके पानी बनने में द गु (m´L) कलरी प्राप्त होती हैं (गु (L)=गुप्त ताप)। इसको पदार्थ द्वारा शोषित उष्मा के बराबर रखकर विशिष्ट उष्मा की गणना कर लेते हैं।
तापवृद्धि के समय बाह्य स्थिति के अनुसार पदार्थों की विशिष्ट उष्मा के अनेक मान होते हैं। एक तो स्थिर आयतनवाली विशिष्ट उष्मा होती है जो उसकी आंतरिक ऊर्जा से संबंधित रहती है। मापन क्रिया के समय आयतन में परिवर्तन होने के कारण आयतनवृद्धि के लिए काम (कर्म) करना पड़ता है और तापवृद्धि के साथ साथ कुछ उष्मा की इस काम के लिए भी आवश्यकता होती है। काम की मात्रा दाब के आश्रित है और यदि यह दाब स्थिर न हो तो यह मात्रा भी परिवर्तित होगी। इसीलिए स्थितियों में भेद होने के कारण विशिष्ट उष्मा के अनेक मान होते हैं, किंतु सुविधा के लिए केवल दो पर ही विचार किया जाता है। एक का संबंध स्थिर आयतन और दूसरे का स्थिर दाब से है और इनको क्रमानुसार विअ 1 (Cv) और विद 1 (Cp)लिखा जाता है ठोसों और द्रवों में तापीय प्रसरण अपेक्षाकृत कम होता है, अत: विशिष्ट उष्मा के अनेक मान लगभग बराबर होते हैं किंतु गैसों में इनमें बहुत अंतर होता है। बहुपरमाण्वीय अणुओं में विशिष्ट उष्मा को अणुभार से गुणा करने पर उनकी आणव उष्मा (मॉलिक्युलर हीट) और एक परमाणुक अणुओं में विशिष्ट उष्मा को परमाणुभर से गुणा करने पर उनकी पारमाण्वीय उष्मा (ऐटॉमिक हीट) प्राप्त होती है। इन दोनों को अंग्रेजी में C और में वी से व्यक्त करते हैं। वैज्ञानिक साहित्य में इनको केवल विशिष्ट उष्मा भी लिखा गया है। इस संबंध में आदर्श गैसों में यह सूत्र लागू होता है:
वीदा - वीअ 1 =झ
Cp -Cv = R
यहाँ पर झ (R) पुर्ववर्णित गैस नियतांक है।
6. विशिष्ट उष्मा के सिद्धांत-1819 में डयूलांग और पेटिट ने यह नियम प्रतिपादित किया कि सब ठोस तत्वों की स्थिर आयतनवाली पारमाण्वीय उष्मा एक ही होती है और उसका मान 5.9४ कलरी/ग्राम परमाणु ´ डिग्री सें. होता है। शीघ्र ही प्रयोगों द्वारा यह सिद्ध हुआ कि हल्के तत्व-कार्बन, बोरन और सिलिकन-इस नियम के अपवाद हैं। पूर्ववर्णित नर्न्स्ट के प्रयोगों से यह ज्ञात हुआ कि ताप कम होने पर यह नियम किसी भी ठोस पर लागू नहीं होता और ताप घटने पर सब तत्वों की पारमाण्वीय उष्मा घटती जाती है, यहाँ तक कि परम शून्य के निकट लगभग शून्य हो जाती है।
किसी समुदाय की ऊर्जा के व्यंजक में जितने वर्ग (स्क्वेयर) पद आते हैं उनकी संख्या उस समुदाय की स्वतंत्रता संख्या (डिग्रीज़ ऑव फ्रीडम) कहलाती है। एकपरमाणुक आदर्श गैसों में यह संख्या3 प्रति अणु और ठोस तत्वों में यह 6 प्रति परमाणु होती है। मैक्सवेल-बोल्ज़मान की सांख्यिकी के अनुसार ठोस पदार्थों की औसत उष्मिक ऊर्जा
श्(झ/ऐ)पाश् श्बो पा। = = kT
प्रति स्वतंत्रता संख्या होती है। यहाँ ऐ (N) एवेगैड्रो संख्या है और यह ग्राम-परमाणु में परमाणुओं की संख्या के बराबर होती है। बो (K) बोल्ज़मान नियतांक है। अत: ऐ (N) परमाणुओं की ऊर्जा
ऊ = 6´½ झ पा =3 झ पा [E= 6´ RT = 3RT]
और वीआ= ताऊ/तापा =3झ =3´1.98=5.9४ कलरी।
Cv= de/dt=3 R= 3 ´ 1.98= 5.94 Calories
इस प्रकार डयूलॉङ और पेटिट का सिद्धांत सिद्ध हो जाता है।
निम्न ताप पर पूर्वोक्त नियम की विफलता को आइंस्टाइन ने 1907 में प्लांक के क्वांटम सिद्धांत के आधार पर समझाने का प्रयास किया। इस सिद्धांत के अनुसार कोई भी स (v) आवृत्तिवाला दोलक ऊर्जा का शोषण अथवा उत्सर्जन केवल प्ल स (hv) बंडलों अर्थात् क्वांटमों में ही करता है। प्ल (h) को प्लांक नियतांक कहते हैं और इसका मान 6.6´10-27 अर्ग सेकंड होता है। इस सिद्धांत से यह सिद्ध होता है कि पारमाण्वीय दोलकों की उष्मिक ऊर्जा
प्ल स/ (ई प्ल स/ बो पा -1) [hv/ (e hv/kt-1)]
प्रति स्वतंत्रता संख्या अथवा
प्ल स/ (ई प्ल स/बो पा-1)[hv/ (e hv/kt-1)]
प्रतिदोलक होती है। आइंस्टाइन ने सब परमाणुओं की आवृत्तियाँ एक ही मानकर पारमाण्वीय उष्मा की गणना की और प्रायोगिक परिणामों को मोटे रूप से समझाया।
आइंस्टाइन ने स्वयं ही स्वीकार किया था कि उसका सब परमाणु की एक ही आवृत्ति मानना उचित नहीं था। डिबाई ने संपूर्ण ठोस को अविरत (कंटिनुअस) मानकर गणना की कि यह ठोस कुल कितने प्रकार से दोलन कर सकता है। अविरत ठोस में यह संख्या अनंत होती है और इस कारण पारमाण्वीय उष्मा भी अनंत ही होनी चाहिए। इससे बचने के लिए डिबाई ने यह निराधार कल्पना की कि एक विशिष्ट आवृत्ति से ऊपर किसी दोलन की संभावना नहीं। यह आवृत्ति ऐसी होती है कि उससे नीचेवाली समस्त आवृत्तियों की कुल संख्या3 ऐ (3N) होती है। प्रति आवृति की औसत ऊर्जा
प्ल स/ई प्ल स/बो पा-1 [hv/e hv/kT-1]
लेने और सब आवृत्तियों की ऊर्जा को जोड़ने पर तत्व की पारमाण्वीय ऊर्जा निकल आती है। इससे अवकलन (डिफ़रेन्सिएशन) द्वारा पारमाण्वीय उष्मा की गणना कर लेते हैं।
बहुत समय तक डिबाई का सिद्धांत प्रायोगिक परिणामों को समझाने में सफल रहा, किंतु कुछ समय पश्चात् उसकी यर्थाथता कम हो गई। बॉर्न ने ठोस के माणिभ स्वरूप को ध्यान में रखा और दोलन वर्णक्रम (स्पेक्ट्रम) को ऐसी आवृत्ति पर समाप्त किया जिसके तरंगदैर्घ्य का संबंध माणिभ की बनावट से है। यह समाप्ति माणिभ की बनावट पर आधारित होने के कारण डिबाई की आवृत्ति समाप्ति से श्रेष्ठ है। बॉर्न के सिद्धांत का ब्लैकमैन, कैलरमैन इत्यादि ने विकास किया और इसके द्वारा प्रायोगिक परिणामों की सफलतापूर्वक व्याख्या की।
भारतीय वैज्ञानिक चंद्रशेखर रमण ने यह सिद्धांत प्रतिपादित किया कि किसी भी उष्मिक दोलन को संपूर्ण ठोस का दोलन मानना त्रुटिपूर्ण है। उनके अनुसार कोई भी उष्मिक दोलन केवल कुछ परमाणु समुदाय का दोलन होता है और प्रत्येक दोलन का यह रूप होता है कि उनमें निकटस्थ माणिभ कोशिकाओं (किस्ट्रल सेलों) में ऊर्जा की मात्रा बराबर होती है। विश्वेश्वरदयाल ने रमण के सिद्धांत द्वारा अनेक ठोसों की पारमाण्वीय उष्मा की गणना की और उनका प्रायोगिक फलों से मेल सिद्ध किया। सिद्धांतत: भिन्न होने पर भी रमण और बॉर्न के सिद्धांतों द्वारा गणना की हुई पारमाण्वीय उष्मा के मान में विशेष अंतर नहीं पाया जाता।
गैसों की आणव उष्मा की गणना करने के लिए उसको तीन भागों में विभक्त किया जाता है जिनका संबंध क्रमानुसार सरल गति, घूर्णन और दोलन से होता है। यदि किसी गैस अणु में स (n) परमाणु हों तो उसकी कुल स्वतंत्रता संख्या3 स (3n) होती है जिसमें तीन सरल गति से, दो या तीन घूर्णन से और शेष दोलन से संबंधित हैं। सरल गति से उत्पन्न आणव उष्मा प्रति स्वंतत्रता संख्या 1/2बो (1/2k) होती है। यदि अणुभार और ताप बहुत कम न हों तो यही प्रभाव घूर्णन का भी होता है, परंतु इनके कम होने पर घूर्णन के प्रभाव की क्वांटम सांख्यिकी द्वारा गणना की जाती है। दोलनका प्रभाव ठोसों के संबंध में वर्णित आइंस्टाइन के सिद्धांत के अनुसार किया जाता है। इस संबंध में प्रयुक्त दोलन आवृत्तियों की गणना रमण प्रभाव और अवरक्त (इनफ्रा-रेड) आवृत्तियों के अध्ययन द्वारा की जाती है।
7. उष्मा का स्थानांतरण-पदार्थों में तीन विधियों से उष्मा का स्थानांतरण होता है जिनको (1) चालन (कंडक्शन), (2) संवहन (कन्वेक्शन) और (3) विकिरण (रेडियेशन) कहते हैं। विकिरण में विद्युच्चुंबकीय तरंगों के रूप में उष्मा एक पदार्थ से दूसरे की ओर यात्रा करती है। ये तरंगें प्रकाश की तरंगों के ही समान होती हैं, किंतु इनका तरंगदैर्घ्य बड़ा होता है। इनका विवरण विकिरण शीर्षक लेख में अन्यत्र दिया गया है। संवहन में द्रव अथवा गैस के गरम अंश गतिशील होकर उष्मा का अन्यत्र वहन करते हैं। इस विधि का उपयोग पानी अथवा भाप द्वारा मकानों के गरम रखने में किया गया है। चालन में पदार्थों के भिन्न खंड़ों में आपेक्षिक गति (रिलेटिव मोशन) नहीं होती; केवल उष्मा एक कण से दूसरे में स्थानांतरित होती रहती है।
चालन के संबंध में यह नियम है कि उष्मासंचारण की दर तापप्रवणताश् (टेंपरेचर ग्रेडिएंट) की समानुपाती होती है। यदि किसी पट्टिका की मोटाई सर्वत्रश् य (x) सेंटीमीटर हो और उसके आमने सामनेवाली सतहों का क्षेत्रफल क्ष (A) वर्ग सेंटीमीटर ओर उनके ताप क्रमानुसार प1 और प2 (t1 and t2) डिग्री सें. हों तो उनके बीच एक सेकंड में संचारित होनेवाली उष्मा की मात्रा मा (Q) निम्नलिखित सूत्र से मिलेगी:
मा = श्चा क्ष ।श्श्श्श्श्
श् इस सूत्र के नियतांक चा (K) को पदार्थ की उष्मा चालकता कहते हैं। यह सूत्र उसी समय लागू होता है जब उष्मासंचारण धीर (स्टेडी) और सतहों के अभिलंबवत् हो। ऐसी अवस्था में सतहों के समांतर बीच की तहों में उष्मा के प्रवाह की दर एक ही होती है। ऐसा न होने पर कुछ उष्मा तापवृद्धि में भी व्यय होती है जिसकी दर एक अन्य विसरणता (डिफ़िज़िविटी) नामक गुणांक पर निर्भर रहती है जो चा/घ वि (K/pS) के बराबर होती है। घ (p) घनत्व और वि (S) विशिष्ट उष्मा है।
धातुओं की उष्मिक चालकता बहुत अधिक होती है। इनके संबंध में बीडमैन-फ्रैज का नियम बहुत महत्वपूर्ण है। इसके अनुसार एक ही ताप पर सब धातुओं की उष्मिक और विद्युतीय चालकता का अनुपात एक ही होता है।
8. उष्मागतिकी-जूल के प्रयोगों ने यह सिद्ध किया कि उष्मा ऊर्जा का ही एक रूप है और वह अपनी मात्रा के अनुपात में ही काम कर सकती है। इसीश् को उष्मागति का प्रथम नियम कहते हैं। इसके अनुसार बिना लगातार ईधंन जलाए किसी उष्मिक इंजन से निरंतर काम नहीं लिया जा सकता। किंतु उष्मा की मात्रा तो चारों ओर अनंत है और इसलिए यह संभावना हो सकती है कि हम चारों ओर के पदार्थों की उष्मा निकालकर उसको काम में परिवर्तित करते रहें और इस प्रकार बिना व्यय के इंजन चला सकें। अनुभव यह बतलाया है कि ऐसा होना संभव नहीं और यही दूसरे नियम का विषय है।
यह नियम उन परिवर्तनों पर लागू होता है जिनमें एक चक्र (साइकिल) के उपरांत समुदाय पुन: अपने मूल रूप में आ जाता है। इसका यह अर्थ है कि हम केवल ऐसे परिवर्तनों पर विचार करेंगे जिनमें उष्मा कर्म में परिवर्तित होती है और इसके अतिरिक्त कोई अन्य परिवर्तन नहीं होता। इस नियम के अनुसार यदि कोई पदार्थ और उसके परिपार्श्व सब एक ही ताप पर हों तो उनकी उष्मा को काम में नहीं बदला जा सकता। ऐसा करने के लिए कम से कम दो भिन्न तापवाले पदार्थों की आवश्यकता होती है और उनसे ताप के अंतर के कारण ही काम करने के लिए उष्मा प्राप्त हो सकती है। इस नियम के मूल में यह तथ्य है कि अणुओं की उष्मिक गति अनियमित होती है और इंजन के पिस्टन की सुनियमित। जैसे ताश के पत्तों को बारंबार फेंटकर उनका नियमित विन्यास करना असंभव सा ही है, ऐसे ही अणुओं की अनियमित उष्मिक गति का भी स्वत: पिस्टन की नियमित गति में परिवर्तित होना अतिदुष्कर है। इंजन जो भी उष्मा काम में परिवर्तित करते हैं उसका कारण यह है कि इसके साथ ही साथ उनमें कर्म करनेवाले पदार्थ कुछ उष्मा भट्ठी से संघनित्र (कंडेन्सर) में स्थानांतरितश् कर देते हैं। इस कारण इसकी आणविक गति की अनियमितता बढ़ जाती है और कुल समुदाय की अनियमितता का ्ह्रास नहीं होता।
आचार्यों ने उष्मागतिकी के दूसरे नियम के अनेक रूप दिए हैं जो मूलत: एक ही हैं, जैसे:
ऐसे उष्मिक इंजन का निर्माण करना संभव नहीं जो पूरे चक्र में काम करते हुए केवल एक ही पिंड से उष्मा ग्रहण करे और काम करनेवाले समुदाय में बिना परिवर्तन लाए उस संपूर्ण उष्मा को काम में बदल दे (प्लांक-केल्विन)।
बिना बाहरी सहायता के कोई भी स्वत: काम करनेवाली मशीन उष्मा को निम्नतापीय पिंड से उच्चतापीय में नहीं ले जा सकती, अर्थात् उष्मा ठंडे पिंड से गरम में स्वत: नहीं जा सकती (क्लाज़िउस)।
कार्नो ने, जो उष्मा के असली स्वरूप से अनभिज्ञ था, एक आदर्श इंजन की कल्पना करके उसकी दक्षता (एफ़िशेन्सी) की गणना की। इसका इंजन पूर्णरूपेण उत्क्रमणीय (रिवर्सिबिल) है। इसका यह अभिप्राय है कि किसी समुदाय की कार्यप्रणाली उलट देने पर उसके समस्त कार्यों की दिशा भी उलट जाती है, अर्थात् यदि सीधी विधि में उष्मा शोषित होती है तो विपरीत विधि में उतनी ही मात्रा उत्सर्जित होगी और यदि सीधी विधि में उत्सर्जित हुई तो विपरीत विधि में उतनी ही शोषित होती है। उत्क्रमणीय परिवर्तन वे ही होते हैं जिनमें निरंतर साम्यावस्था (ईक्विलिब्रियम) रहती है।
कार्नो के इंजन का विवरण देने से पूर्व यह बतलाना आवश्यक है कि जिन परिवर्तनों में बाहरी उष्मा का आवागमन नहीं होता उनको स्थिरोष्म (ऐडियाबैटिक) कहते हैं। इनके कारण यदि आयतन में वृद्धि होती है तो दाब के विपरीत काम करने के कारण समुदाय ठंडा हो जाता है और इसके विपरीत आयतन में कमी होने से समुदाय गरम हो जाता है। यदि बाहरी उष्मा के संपर्क से समुदाय का ताप स्थिर रहे तो परिवर्तन को समतापीय (आइसोथर्मल) कहते हैं।
कार्नो के इंजन में ऐसे सिलिंडर की कल्पना की गई हैं जिसमें कोई आदर्श गैस भरी होती है और जिसकी दीवारों और पिस्टन में से उष्मा का
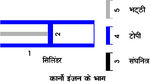
चालन नहीं हो सकता। किंतु उसकी पेंदी पूर्णतया चालक होती है। इसके साथ एक टोपी भी होती है जो पेंदी पर ठीक बैठ सकती है और दीवारों की तरह पूर्णतया पृथक्कारी (इनसुलेटर) होती है। एक ताप पा1 (T1) की भट्ठी और ताप पा2 (T2) के संघनित्र की भी व्यवस्था रहती है। ये अवयव चित्र 1 में प्रदर्शित हैं।
कानों का चक्र निम्नलिखित क्रियाओं द्वारा पूरा किया जाता है:
(क) सिलिंडर को भट्ठी 5 पर बैठा दिया जाता है और पिस्टन को धीरे धीरे बाहर खींचते जाते हैं जिससे गैस और भट्ठी का ताप निरंतर बराबर पा1 (T1) रहता हैं। यह क्रिया समतापीय है। गैस की प्रारंभिक स्थिति चित्र (2) के बिंदु क (A) से प्रकट है और वह समतापरेखा क ख (AB) से होती हुई अंत में स्थिति ख (B) में पहुँच जाती है। इस क्रिया में ताप स्थिर रखने के लिए गैस भट्ठी से उष्मा मा1 (Q1) लेती है और चित्र के क्षेत्रफल क ख ख¢क¢ (A B B¢ A¢) के बराबर पिस्टन पर काम करती है।

चित्र 2. कार्नो इंजन का सूचक चित्र
(ख) अब सिलिंडर का भट्ठी से संपर्क तोड़कर उसकी पेंदी पर टोपी बैठा दी जाती है। पिस्टन अब भी धीरे-धीरे बाहर खिंचता जाता है। उष्मापृथक्करण (हीट इन्सुलेशन) होने के कारण यह क्रिया स्थिरोष्म है और गैस ख (B) से स्थिरोष्म रेखा ख ग (B C) पर होती हुई स्थिति ग (C) पर पहुँच जाती है। अब ताप पा1 (T1) से गिरकर पा2 (T2) हो जाता है और गैस पिस्टन पर ख ग ग¢ ख¢ (B C C¢ B¢) काम करती है।
(ग) अब टोपी हटाकर सिलिंडर को संघनित्र ताप पा2 (T2) पर बैठा दिया जाता है। पिस्टन धीरे-धीरे भीतर की ओर जाता है। और गैस समतापीय-रेखा ग घ (C D) से होकर बिंदु घ (D) पर पहुँच जाती है। इस विधि में गैसश् मा2 (Q2) उष्मा संघनित्र को देती है और पिस्टन उसपर ग ग¢ घ¢ घ (C C¢D¢D) काम करता है।
(घ) संघनित्र से सिलिंडर को हटाकर उसपर पुन: टोपी बैठा दी जाती है। पिस्टन धीरे-धीरे अंदर की ओर जाता है और गैस स्थिरोष्म मार्ग घ क (DA) सेश् होकर आदि स्थान श्क (A) पहुँचती है। पिस्टन गैस पर कार्य घ घ¢ क¢ क (D D¢A¢A) करता है और गैस का ताप बढ़कर पुन: पा1 (T1) हो जाता है। इस प्रकार कार्नो का चक्र पूर्ण होता है। इसके परिणाम ये होते हैं:
(1) गैस द्वारा किए हुए काम में से उसपर हुए काम को घटाकर कुल चक्र में क ख ग घ (A B C D) के बराबर काम होता है।
(2) भट्ठी गैस को उष्मा मा1(Q1) देती है जिसमें से वह संघनित्र को उष्मा मा2 (Q2) देकर शेष को श्क ख ग घ (A B C D) कार्य करने में व्यय करती है।
इस चक्र की समस्त क्रियाएँ साम्यावस्था में होने के कारण उत्क्रमणीय (रिवर्सिबिल) हैं। इसकी
श् श्श्श्श्श्श्श्श्श्
श्श्श्श्श् श्श्श्श्श्श्श्श्श्श्श्श्श् श्दक्षता = प्राप्त काम श्श्श्श् श्श्श्श्
भट्ठी से प्राप्त उष्माश् श्श्श्श्श्
कार्नो ने सिद्ध किया कि किसी भी इंजन की दक्षता उत्क्रमणीय इंजन से अधिक नहीं हो सकती और सिलिंडर के भीतर कोई भी पदार्थ क्यों न काम करे, समस्त उत्क्रमणीय इंजनों की दक्षता एक ही होती है। इसी को कार्नो प्रमेय कहते हैं। कार्नो के प्रमाण का आधार यह है कि यदि कोई अन्य इंजन उत्क्रमणीय इंजन से अधिक दक्ष हो तो इन दोनों को उचित रूप से जोड़कर कम तापवाले संघनित्र से बिना अन्य परिवर्तन किए उष्मा निकालकर काम कराना संभव हो सकता है। यह उष्मागतिकी के द्वितीय नियम के अनुसार संभव नहीं।[1]
9. परम तापक्रम-(ऐब्सोल्यूट स्केल ऑव टेंपरेचर)-कार्नो इंजन की दक्षता उसके सिलिंडर में भरे हुए पदार्थ और उसकी अवस्था पर आश्रित नहीं होती और केवल भट्ठी तथा संघनित्र के तापों पर निर्भर रहती है। इस कारण लार्ड केल्विन ने सुझाव दिया कि इसी को तापमापन का आधार बनाना उचित होगा। इस नवीन मापक्रम में भट्ठी से कार्नो इंजन द्वारा शोषित उष्मा मा1 (Q1)और संघनित्र को दी हुई उष्मा मा2 (Q2) इन दोनों का अनुपात उनके ताप थ1 (q1) और थ2 (q2) के अनुताप के बराबर होता है। अर्थात्
मा1/मा2 थ/1 थ3
Q1 Q2 q1/q2
यदि भट्ठी शुद्ध पानी के क्वथनांक पर और संघनित्र हिमांक पर हो तो उन दोनों के तापों का अंतर 1000 परम माना जाता है, अर्थात्
मा1(क्वथनांक)श्श्श्श्श्श्श्श् थ0Q+100श्श्श्श्श्श् Q1 (क्वथनांक)श्श्श्श्श्श्श्श्श् q0+ 100
श्श्श्श्श्श् =श्श्श्श्श्श् ----------------।श्श्श्श्श्श्श्श्श्श्श्श्श् --------------------श्श्श्श्श् =श्श्श्श्श्श्श्श्श्श्श्श्श् ----------
मा2 (हिमांक)श्श्श्श्श्श्श्श्श्श्श्श्श् थश्श्श्श्श्श्श्श्श्श्श्श्श्श्श्श्श्श्श्श्श्श्श्श्श्श्श्श्श्श्श्श्श् Q2 (हिमांक)श्श्श्श्श्श्श्श्श्श्श्श्श् q0
यहाँ पर थ0 (q0) परम मापक्रम में हिमांक का मान है। यदि मा2 (Q2)शून्य हो तो थ0 (q0) भी शून्य होता है। इसी को परम शून्य (ऐब्सोल्यूट ज़ीरो) कहते हैं। ताप पर संघनित्र को रखने से भट्ठी की संपूर्ण उष्मा काम करने में व्यय होगी अत: यह स्पष्ट है कि इससे निम्न ताप संभव नहीं हो सकता। अंतर्राष्ट्रीय निश्चय के अनुसार अब केवल हिमांक को 273.160° मानकर ही परम डिग्री का मान निर्धारित किया जाता है।
कार्नो का इंजन आदर्श मात्र है, व्यावहारिक नहीं। अत: यह मापक्रम भी व्यावहारिक नहीं हो सकता। परंतु सिद्धांतनुसार आदर्श गैसों के मापक्रम का ताप पूर्वोक्त उष्मागतिकी अथवा परम पैमाने के ताप के बराबर होता है, अत: आदर्श गैस मापक्रम को काम में लाया जाता है। किंतु इसकी प्रामाणिकता उष्मागतिकी मापक्रम पर ही आधारित है।
अधिक जानकारी के लिए उष्मागतिकी शीर्षक लेख देखें।[2]
|
|
|
|
|
|
टीका टिप्पणी और संदर्भ
- ↑ हिन्दी विश्वकोश, खण्ड 2 |प्रकाशक: नागरी प्रचारिणी सभा, वाराणसी |संकलन: भारत डिस्कवरी पुस्तकालय |पृष्ठ संख्या: 150-56 |
- ↑ सं.ग्रं.-जे.सी.मैक्सवेल : थ्योरी ऑव हीट, 11वाँ संस्करण, 1894; पी.एस. एप्स्टाइन : थर्मोडायनामिक्स (1937); आर.एच. फ़ाउलर और ई.ए. गुगेनहाइम : स्टैटिस्टिकल थर्मोडायनामिक्स (1937); जे. जीन्स : द डायनैमिकल थ्योरी ऑव गैसेज़ (1921); साहा और श्रीवास्तव : हीट। इस संबंध में अग्रलिखित लेख भी इस विश्वकोश में द्र. : उष्मागतिकी, उष्मामिति, उष्मायन, ऊर्जा, क्वांटम यांत्रिकी, क्वांटम सांख्यिकी, तापमान, तापविद्युत्, वाष्पायन, विकिरण।